Какие из арахидоновой кислоты. Арахидоновая кислота: свойства, формула, биологическая роль. Источники арахидоновой кислоты. Нарушение метаболизма арахидоновой кислоты: реакция организма, псевдоаллергия, лечение
Читайте также
Содержание статьи:
Для билдеров арахидоновая кислота является новым продуктом. Как это происходило со всеми видами добавок, применение арахидоновой кислоты вызывает массу споров. Для кого-то это крайне эффективное средство, а другие атлеты уверены, что это очередной бесполезный продукт. Мы постараемся придерживаться в этом вопросе полного нейтралитета и расскажем, какая польза и вред арахидоновой кислоты могут быть получены спортсменами.
Что такое арахидоновая кислота?
В пользе ненасыщенных жиров сегодня сомневаться не приходится, так как ученые доказали этот факт. Сейчас у каждого человека и тем более спортсмена на слуху слово «омега-3». В сети очень много статей, посвященных этому веществу. А вот омега-6 большинству людей не так хорошо известна, хотя для организма эти вещества также весьма важны.
Омега-6 жирные кислоты активно участвуют во всех метаболических реакциях, ускоряют процессы липолиза, снижают риск развития артрита, а также нормализуют работу эндокринной системы. Когда разговор заходит о пользе и вреде арахидоновой кислоты, то сразу следует сказать, что это вещество принадлежит к группе омега-6.
Именно этим фактом в первую очередь и можно объяснить популярность добавки в среде билдеров. Заметим, что это вещество считается незаменимым, хотя некоторые ученые с этим не согласны и уверены в том, что она может быть синтезирована организмом самостоятельно.
Польза и вред арахидоновой кислоты

Сейчас мы рассмотрим вопрос о пользе и вреде арахидоновой кислоты с биохимической точки зрения. Ученые достаточно хорошо изучили вещество и большинство выполняемых им функций уже известно. В тоже время часть свойств данного соединения еще точно не установлено. Сейчас можно смело говорить, что арахидоновая кислота может быть эффективным средством профилактики старческого слабоумия, а также болезни Альцгеймера.
Не менее важным является и способность вещества улучшать работу головного мозга. Это очень важно при сильных физических нагрузках, так как они производят на нервную систему сильное негативное воздействие. Необходима арахидоновая кислота и для синтеза простагландинов. Данные вещества улучшают работу мускулов, увеличивая их выносливость и силу.
Кроме этого именно благодаря простагландинам мускулы могут сокращаться, а затем расслабляться, когда нагрузка снимается. Данная функция имеет огромное значение для любого человека, а для билдеров в особенности. Не стоит забывать и об участии простагландинов в процессах создания новых кровеносных сосудов, контроле давления крови, а также снятия воспалительных процессов в мускульных тканях.
Если говорить о пользе и вреде арахидоновой кислоты, то стоит отметить и участие вещества в процессе синтеза слизистой желудка и кишечного тракта. Это говорит о том, что арахидоновая кислота обеспечивает защиту органов пищеварения от разрушительного воздействия соляной кислоты, составляющей основу желудочного сока. В ходе последних исследований ученым удалось обнаружить, что все жирные кислоты необходимы для процессов восстановления мускульных тканей. Еще один аргумент в пользу необходимости дополнительного приема этой добавки.
Арахидоновая кислота и продукты питания

Так как эта жирная кислота не может быть синтезирована организмом, то единственным источником в таком случае являются продукты питания. Давайте узнаем, как можно получить это вещество с помощью питания. Получить арахидоновую кислоту можно из большого количества продуктов, содержащих жир, например, свинины, яиц или курицы.
Однако вам должно быть известно, что в программе питания спортсмена жиры должны содержаться в небольших количествах. В противном случае вы не сможет набирать сухую массу, а от лишнего жира избавиться достаточно сложно. Большинство спортсменов уверены, что польза и вред арахидоновой кислоты определяются происхождением вещества.
Так как это ненасыщенная жирная кислота, то ее необходимо считать полезной. Однако ученые доказали, что «полезных» жиров просто нет в природе. Если любые виды жиров поступают в организм в больших количествах, то увеличения адипозных тканей не миновать.
Следует сказать и о суточной потребности организма в этом веществе - 5 грамм. При этом организм ежедневно нуждается в 8–10 граммах полиненасыщенных жирных кислот. На самом деле с арахидоновой кислотой не все так просто, как кажется. Известная многим атлетам линолевая кислота может быть при необходимости конвертирована как раз в арахидоновую. Причем второе вещество является более активным с биологической точки зрения.
Основным источником арахидоновой и линолевой кислот является свиное сало. Для получения суточной дозы арахидоновой кислоты необходимо съесть 250 грамм этого продукта. Вполне очевидно, что так поступать не стоит, но факт им и остается. Остальные продукты питания содержат арахидоновую кислоту в значительно меньших количествах.
Из этого можно сделать вывод, что стоит сделать акцент на употреблении линолевой кислоты, ведь организм может превратить ее в арахидоновую, если такая необходимость возникнет. Напомним, что линолевая кислота содержится в растительных маслах. Достаточно на протяжении суток употреблять по 20 грамм этих продуктов и дефицита арахидоновой кислоты не будет.
Польза и вред арахидоновой кислоты в бодибилдинге

Пришло время выяснить, какую пользу и вред арахидоновой кислоты могут получить атлеты. Хотя это вещество учеными изучено достаточно хорошо, в спорт оно пришло недавно. Мы уже отмечали, что арахидоновая кислота используется для синтеза простагландинов. В результате ускоряется процесс производства протеиновых структур, ускоряется гипертрофия волокон мышц, хотя секреты последнего процесса еще не раскрыты. Кроме этого арахидоновая кислота увеличивает показатель чувствительности тканей к мужскому гормону.
Здесь сразу хочется вспомнить об атлетах, тренирующихся натурально. С научной точки зрения это свойство кислоты объясняется способностью увеличивать число рецепторов андрогенного типа в тканях мускулов. Именно это и является одним из основных преимуществ, которые имеют так называемые генетически одаренные билдеры.
Но это еще не все, ведь арахидоновая кислота стимулирует процессы производства фермента фосфатидилинозитолкиназа. Под этим сложным в произношении веществом скрывается фермент, ускоряющий производство ИФР и инсулина. Все эти факты должны говорить нам о том, что без дополнительного приема арахидоновой кислоты спортсменам практически не обойтись. И снова на практике все оказывается сложнее, чем в теории.
Пока сложно с полной уверенностью говорить, что арахидоновая кислота на сто процентов будет эффективна в виде добавки. Если внимательно изучить результаты исследований, проводимых компаниями-производителями спортпита. То бросается в глаза небольшое количество этих экспериментов.
Наиболее правильным решением при разговоре о пользе и вреде арахидоновой кислоты, является изучение практического опыта спортсменов. На Западе эта добавка стала использоваться билдерами значительно раньше в сравнении с отечественными спортсменами. Таким образом, у нас есть возможность разобраться в отзывах атлетов.
Сразу следует сказать, что практически все билдеры отмечают усиление пампинг-эффекта. Однако нельзя с полной уверенностью говорить, что вся заслуга в этом принадлежит именно арахидоновой кислоте, так как она не является единственным ингредиентом. Кроме этого спортсмены часто говорят об усилении болевых ощущений после интенсивного тренинга, что также можно отнести к положительным свойствам добавки. Также есть свидетельства и об ускорении набора массы, но снова следует сказать, что культуристы используют массу добавок и что именно ускоряет процесс набора массы, говорить сложно.
Как бы там ни было, арахидоновая кислота определенно заслуживает внимания к себе. Причем это касается не только натуральных атлетов, но и билдеров, использующих спортфарму. Мы выше уже говорили о том, что после высвобождения из поврежденных во время тренинга мембран клеток мускульных тканей, вещество конвертируется в простагландины. Это повышает чувствительность тканей к мужскому гормону, инсулину и ИФР.
Однако это справедливо не только к эндогенным гормонам, но и тем, которые были введены извне. Также необходимо заметить, что организм достаточно быстро расходует запас арахидоновой кислоты, который затем восстанавливается длительное время.
Как правильно принимать арахидоновую кислоту?

Итак, польза и вред арахидоновой кислоты нами только что были изучены, остается выяснить, как необходимо принимать эту добавку. Очень часто они назначаются при сильных болевых ощущениях в мускулах. Это связано со способностью данной жирной кислоты ускорять процессы регенерации. В последнее время производители стали часто добавлять арахидоновую кислоту в гейнеры, хотя ее содержание в этом виде спортпита невелико.
В период набора массы рекомендуется употреблять от 0.5 до 1 грамма арахидоновой кислоты. Перед тем, как приобретать соответствующие добавки, настоятельно рекомендуем внимательно изучить их состав. Зачастую фактическая концентрация этого компонента в них крайне мала. В этой ситуации вам необходимо найти добавку от другого производителя или же увеличить дозировку, чтобы поучать в результате рекомендованное количество арахидоновой кислоты.


Причина дерматита. Пока врачи списывают раздражение кожи на аллергические реакции, ученые из университета Илинойза выяснили истинную причину заболевания. К нему ведет дефицит арахидоновой .
Она синтезируется организмом из , поступающей с пищей. За синтез ответственны ферменты, а за их выработку определенные гены. Специалисты университета блокировали их в ДНК мышей.
У грызунов начинался выраженный язвенный дерматит. Ученые учли, что арахидоновая кислота есть в готовом виде в ряде продуктов. Во время эксперимента их мышам не давали.
Как только в рацион вводилось арахидоновое соединение, грызуны выздоравливали. Так развеяли миф о необходимости организму линолевой . Раньше благостное влияние на приписывали ей. Оказалось же, что линолевое вещество – лишь ресурс для синтеза поистине необходимого для организма. Последнему и посвящаем .
Свойства арахидоновой кислоты
Содержится арахидоновая кислота в сале и ряде растительных масел. Поэтому, соединение называется жирным. Арахидоновая кислота относится к жирным ненасыщенным.
В таких есть минимум 1-а двойная связь меж атомами . Она делает молекулу подвижной. Посему, арахидоновая жирная кислота в нормальном состоянии жидкая, маслянистая.
Насыщенные же соединения двойных связей не содержат, и, как показывает практика, вредные. Однако, вред несет лишь переизбыток, переходящий в жир.
Плюс насыщенных жирных в высокой энергетической ценности. Для расщепления соединений не требуются желчные . Организм не тратит ресурсы, лишь получает их.
Ненасыщенная арахидоновая , напротив, сжигает жиры и требует затрат организма на свое расщепление. Затраты эти колоссальны, поскольку двойных связей в молекуле героини статьи ни 1, 2, а целых 4. Общая формула арахидоновой кислоты : — С 20 Н 32 С 2 .
Формула арахидоновой кислоты
Четное число атомов углерода – обязательное условие для всех жирных . Так же, все они имеют линейное строение. Это значит, что атомы углерода не замыкаются в ароматические круги.
Героиня статьи относится к группе «Омега-6», для ряда соединение незаменима. , к примеру, пользу арахидоновой кислоты черпают исключительно из пищи.
Проще, но его организм страдает от неспособности вырабатывать ряд других ненасыщенных жиров типа линоленового. У последнего есть свойство, роднящее его с героиней статьи. Оба вещества неустойчивы. Как и линоленовая , арахидоновая легко окисляется.
Организму же соединение нужно, в основном, в чистом виде. Из такой путем метаболизма получаются анандамид и 2-арахидонилглицерин. Это сигнальные молекулы. Именно они обеспечивают связь между нейронами, из коих «соткана» система.
Получение арахидоновой кислоты
Название кислоты обусловлено тем, что ее гидрирование приводит к образованию арахинового соединения – основы арахиса. Соответственно, дегидрирование масел ореха может дать героиню статьи. Однако, такой метод производства невыгоден, затратен.

Продукты, содержащие арахидоновую кислоту
В основном, героиню статьи получают микробиологическим методом. Для него нужны субстрат на основе глицерина и грибы Moriterella alpine. Последние питаются спиртом. Продуктом анаэробной реакции становится арахидоновая кислота.
Вред микробиологическое производство не несет. Побочные продукты питания грибов глицерином тоже пригождаются промышленникам. Полный отчет о методике получения кислоты можно найти на сайте института биохимии и физиологии микроорганизмов имени Скрябина. Учреждение открыто при Российской академии наук. Именно здесь разработана методика, поэтому, активно применяется в .
Применение арахидоновой кислоты
Героиню статьи взяли на вооружение в сельском хозяйстве. примешивают к гербицидам. В них вещество не дополняет отравляющий комплекс, а снижает его вредоносное действие на сельскохозяйственные культуры.
Арахидоновая кислота для растений в гербицидах повышает урожайность на четверть. Таков показатель для овощных и злаковых культур. Иначе говоря, героиня статьи служит своеобразным удобрением.

Арахидоновая кислота в капсулах
Оно сводит к минимуму накопление ядов, как в плодах, растениях, так и в почве. Куда же деваются вредные компоненты гербицидов? Разлагаются. Для реакции распада арахидоновая – обязательный элемент.
Около 10-ти лет назад интерес в каких продуктах арахидоновая кислота содержится проявили бодибилдеры. Они прочли труды Уильяма Ллевилина. Его статьи публикуются в журнале Body of Science Magazine.
Уильям поведал публике об участии арахидоновой кислоты в синтезе простагландинов. В них всегда 20 атомов углерода. Простагландин с названием «ПГЕ-2-альфа» провоцирует гипертрофию мышечных волокон.
Активно добавляя сверх нормы выработки организмом, бодибилдеры быстро наращивают массу, причем, не жировую. Однако, есть мера арахидонового соединения. В обычных условиях организму в сутки требуются 5 граммов.
Активные физические нагрузки увеличивают расход, в частности, потому что кислота отвечает за сокращение и расслабление мышц. Больше сокращений – больше затраты арахидонового вещества.
Организм не всегда успевает синтезировать нужное количество арахидоновой , особенно, в отсутствии поступления линолевой. Поэтому, в ход идут фитнес-добавки.
Хотя, некоторые тренера замечают, что логичнее сосредоточиться на потреблении продуктов с линолевой . Ее много в баранине, говядине и мясе . Богаты веществом молочные продукты, маргарины, растительные масла.

Химическая формула арахидоновой кислоты
Если же разбирать, где содержится арахидоновая кислота , то это творог. В нем соединения 0,4 грамма на 100 граммов продукта. Столько же находим в горбуше и скумбрии.
На 0,1 грамма меньше в 20-процентной сметане. 0,2 грамма соединения содержится в 100-та граммах говяжьего языка. В прочих продуктах доля арахидоновой ничтожна мала.
Медики присмотрели арахидоновую как средство профилактики и борьбы с болезнью Альцгеймера. На ранних стадиях прием героини статьи блокирует развитие недуга. Он заключается в потере памяти.
Получается, арахидоновая стимулирует мыслительную деятельность. Это берут на заметку и спортсмены. При активных физических нагрузках мозг теряет часть полагающегося ему питания, все ресурсы бросаются на работу мышц.
Прием арахидонового соединения исправляет ситуацию, а с ней и стереотип, что все кочки недалекого ума. Как видно, у мнения было научное обоснование.
Интересует врачей арахидоновая и в виде простагландинов. Одна из их функций – увеличение просвета сосудов. Соответственно, можно избежать образование тромбов, контролировать давление крови.
Однако, есть ряд простагландинов на основе арахидонового соединения, улучшающих свертываемость крови. Это, напротив, ведет к ее загустеванию, тем же тромбам.
Последние представляют бляшки запекшейся , приклеившиеся к стенкам сосудов. Если тромб отрывается, он начинает продвигаться по каналам, может дойти до сердца и вызвать его остановку. В этом заключается потенциальный вред арахидоновой кислоты , будь она в избытке.

Последнее поприще действий арахидонового соединения – косметология. Кислота борется с акне. Соответственно, героиню статьи добавляют в средства от прыщей. Главное, хранить их в непрозрачной и герметичной таре. На свету, при контакте с кислородом активное вещество разрушается, а вместе с ним и мечты о чистой коже.
Цена арахидоновой кислоты
Купить арахидоновую кислоту в магазине спортивного питания, значит, приобрести таблетки или капсулы. Если в упаковке их около 20-ти, отдадите примерно 3 000 рублей.
Красивое тело, как видно, требует финансовых жертв. Не зря в США сложился стереотип, что люди спортивного телосложения обеспеченные, а толстяки – беднота. Этому есть социальная подоплека.
При малом достатке люди не могут тратиться на фитнес-клубы, тренажеры, натуральную и полезную еду, те же пищевые добавки. Арахидоновая в чистом виде относится к последним, то есть не является лекарственным средством.
Гербициды на основе арахидонового соединения представляют, как правило, его спиртовые растворы. Кроме ядов в них есть ряд антиоксидантов. Только вот, препаратов близка к бадам для бодибилдеров.
За упаковку объемом 0,25 литра с гербицидом «Вояж» компании Argo-03, к примеру, просят почти 2 000 рублей. Есть гербициды по 32 000 рублей за килограмм, а есть и за 680.
Однако, в товарах последней ценовой категории арахидоновая кислота содержится редко и в недостаточных количествах. На 1 гектар земли нужно потратить 1 грамм соединения.
Арахидоновая кислота является , относится к классу омега-6-ненасыщенных жирных кислот. Любопытно, что существуют разногласия касательно того, стоит ли считать арахидоновую кислоту незаменимой, ведь она в небольшом количестве вырабатывается в человеческом организме.
Формально, для причисления жирной кислоты к незаменимым, организм должен получать ее из внешней среды, будучи не в состоянии ее синтезировать. Однако, поскольку наше тело не может полностью покрыть потребность в арахидоновой кислоте за счет эндогенного синтеза, большая часть медицинских сайтов и сайтов, посвященных пищевым добавкам, относит арахидоновую кислоту скорее к незаменимым, нежели и заменимым жирным кислотам.
В связи с этим в рамках данного материала мы также будем называть арахидоновую кислоту незаменимой. В статье будут перечислены источники арахидоновой кислоты, ее функции, а также спорные вопросы, касающиеся данного компонента питания.
Возможные побочные эффекты арахидоновой кислоты
- Бессонница
- Утомление
- Нарушение мозгового кровообращения
- Заболевания сердца
- Ломкость волос
- Шелушение кожи
- Повышение уровня холестерина
- Стимуляция родовой деятельности
Области применения арахидоновой кислоты
- Болезнь Альцгеймера
- Артериальная гипертензия
- Повышение умственных способностей
- Свертываемость крови
- Воспаление
- Память
- Мышечная сила
- Язвенная болезнь
- Стимуляция родов
Откуда получить арахидоновую кислоту?
Арахидоновая кислота содержится в жирных продуктах и является компонентом жиров постных блюд. Вы можете получить арахидоновую кислоту из красного мяса, свинины, домашней или дикой птицы, яиц и многих других яств. Поскольку арахидоновая кислота составляет определенную долю жиров в повседневных продуктах, важно корректировать рацион питания, поскольку избыток жиров может негативно сказываться на состоянии здоровья.
Так как арахидоновая кислота является полиненасыщенной, многие ошибочно считают ее «полезным жиром». Истина заключается в том, что эта жирная кислота поступает в составе животных жиров, и, как и все жиры, при чрезмерном потреблении приносит организму больше вреда, нежели пользы.
Препараты арахидоновой кислоты
Еще один источник арахидоновой кислоты – пищевые добавки. Вы можете принимать арахидоновую кислоту в виде таблеток, капсул или порошка. Наиболее распространенной является порошковая форма, так как она лучше всего усваивается организмом. Заметим, что добавка горька на вкус, и многие разводят порошок в цитрусовом соке, для того чтобы хоть как-то скрыть эту горечь.
Также вы обнаружите, что арахидоновая кислота продается как в чистом виде, так и в составе комплексных препаратов. Цена на эти продукты изменяется в широком диапазоне, от 10 до 100 долларов, в зависимости от того, какой объем вы покупаете, и что входит в состав комплекса, помимо арахидоновой кислоты.
Биологическая роль арахидоновой кислоты
Многие функции арахидоновой кислоты уже доказаны, а некоторые до сих пор находятся на стадии изучения. Поскольку арахидоновая кислота является незаменимой жирной кислотой, в настоящее время проводится несколько независимых клинических исследований, посвященных изучению роли и эффективности этой кислоты в различных отраслях медицины.
Одной из таких областей является влияние арахидоновой кислоты на прогрессирование болезни Альцгеймера при использовании на ранних стадиях заболевания. Предварительные данные показывают, что арахидоновая кислота может назначаться как для предупреждения болезни Альцгеймера, так и для замедления темпов прогрессирования недуга при лечении пациентов с уже диагностированной патологией.
Арахидоновая кислота участвует в синтезе простагландинов, которые поддерживают работу мышц. Конкретно простагландины обеспечивают правильное сокращение и расслабление мышечных волокон во время нагрузки. Данная функция имеет значение для всех и каждого, но особенно она важна для спортсменов и бодибилдеров.
Простагландины помогают регулировать просвет сосудистого русла и способствуют образованию новых кровеносных сосудов, контролируют артериальное давление и моделируют воспаление в мышцах. Одна из форм простагландинов повышает свертываемость крови, в то время как иная форма, напротив, предотвращает повышенное тромбообразование там, где ему не место. Эта форма простагландина, известная как PGE2, также используется для стимуляции родовой деятельности у беременных женщин.
Арахидоновая кислота предупреждает чрезмерный синтез соляной кислоты в пищеварительном тракте, кроме того, она повышает выработку защитной слизи, которая помогает предотвратить развитие язвенной болезни и других проблем с желудком, в том числе и желудочных кровотечений.
Помимо этого арахидоновая кислота способствует росту и регенерации скелетной мускулатуры и мышечных волокон. Особенно велика ее роль в развитии костно-мышечной системы у детей; без арахидоновой кислоты адекватное физическое развитие ребенка фактически невозможно.
Арахидоновая кислота и воспаление
Эта жирная кислота является провоспалительной, что означает, что она способствует развитию воспалительных процессов в тканях и мышцах. Но это далеко не всегда плохо, за исключением тех случаев, когда вы страдаете воспалительными заболеваниями. А выраженность воспалительной реакции может быть уменьшена приемом аспирина, других добавок или продуктов, обладающих противовоспалительным действием.
В случае с арахидоновой кислотой мы имеем дело с воспалением, которое бодибилдеры и тяжелоатлеты должны взять на вооружение. Существует предположение, что стимулирующее действие арахидоновой кислоты в процессе тренировочных сессий связано с тем, что мышцы получают дополнительный воспалительный сигнал, который повышает эффективность тренировок.
Правда, данное предположение не было подтверждено клиническими исследованиями. Напротив, в ряде испытаний никакого дополнительного воспаления после тренировочных сессий обнаружено не было. Однако данные исследования в Университете Бейлор показали, что ежедневный прием 1 200 мг арахидоновой кислоты действительно приводит к увеличению пиковой мышечной силы и мышечной выносливости (30 человек принимали препарат на протяжении 50 дней).
Заметим, что это исследование не было достаточно продолжительным, для того чтобы достоверно доказать эффективность арахидоновой кислоты, и результаты этой работы считаются предварительными. В настоящее время Университет Бейлор не оценивает отдаленные результаты, так как первоначально они ставили перед собой иную цель — доказать, что прием арахидоновой кислоты НЕ дает никаких преимуществ тяжелоатлетам.
Арахидоновая кислота и повышение умственных способностей
В исследованиях, проведенных Американским Национальным институтом Здоровья Ребенка и Развития Человека, изучалось влияние арахидоновой кислоты на развитие мозга малышей в возрасте от 18 месяцев. Это 17-недельное исследование показало отсутствие значительного повышения уровня интеллекта у детей данной группы. Целью дальнейших исследований является изучение наличия прочих положительных эффектов.
А вот исследования, проведенные в прошлом, уже подтвердили благотворное влияние арахидоновой кислоты на способности к запоминанию у взрослых. Именно эти работы инициировали проведение исследований по влиянию арахидоновой кислоты на развитие умственных способностей у детей.
Резюме. Арахидоновая кислота:
- Усиливает свертываемость крови при травмах
- Улучшает память у взрослых
- Способствует правильной работе мышц
- Активно изучалась в недавнем прошлом
- Способствует физическому и умственному развитию ребенка
- В настоящее время исследуются новые сферы ее применения
- Незаменимая жирная кислота
- Используется для стимулирования родовой деятельности
- Может помогать тяжелоатлетам в достижении новых целей
- Может оказывать положительный эффект при болезни Альцгеймера
Побочные эффекты и проблемы, связанные с арахидоновой кислотой
Как уже было сказано, источником арахидоновой кислоты являются жиры. Уже доказано, что высокие дозы арахидоновой кислоты могут привести к патологии сердечнососудистой системы, инфаркту миокарда и нарушению мозгового кровообращения. Более того, в слишком высокой концентрации арахидоновая кислота становится токсичной и может стать причиной смерти. По этой причине не стоит принимать арахидоновую кислоту без наблюдения врача.
Передозировка арахидоновой кислоты может проявляться следующими субъективными симптомами и клиническими признаками: усталость, бессонница, ломкость волос, шелушение кожи, высыпания на коже, запор, сердечные приступы и повышение уровня холестерина.
Поскольку арахидоновая кислота может стимулировать родовую деятельность, ее ни в коем случае нельзя принимать беременным, а также женщинам, которые пытаются зачать ребенка. В этих случаях прием препарата может привести к выкидышу. Кроме того, арахидоновая кислота противопоказана при следующих заболеваниях:
- Онкологическая патология
- Астма
- Повышение уровня холестерина
- Заболевания сердечнососудистой системы
- Увеличение предстательной железы
- Воспалительные заболевания
- Синдром раздраженного кишечника
В любом случае, вы не должны начинать прием арахидоновой кислоты без ведома и разрешения вашего доктора. Это особенно актуально, если вы страдаете каким-либо заболеванием или принимаете лекарственные препараты.
Широко распространено заблуждение, что, принимая натуральные препараты, мы находимся в безопасности. Не забывайте, ядовитый плющ тоже натурален, но не станем, же мы его есть только из-за того, что он растет на природе.
Арахидоновая кислота настолько важна, что не затронуть ее тему было бы неправильно. Особенно в свете недавней статьи , ценность которых дополняют Омега-6 жирные кислоты, непосредственно связанные с арахидоновой.
Она настолько «самобытна», что однозначно хвалить или ругать ее не стоит. С одной стороны она жизненно необходима, а с другой…
Впрочем, не будем тянуть слона за хобот и выясним, что такое арахидоновая кислота, какова ее роль в человеческой физиологии и где ею можно «заправиться».
Что такое арахидоновая кислота
Почему заменимая? – Потому что организм не слишком зависит от внешних источников и сам занимается ее производством. Правда, своих мощностей на 100% не хватает и надо знать, где ее взять.
По важности для организма она незаменима. Присутствует практически в каждом его «уголке», потому что важна для построения мембран клеток. Наибольшая концентрация – в печени, мозгу, мышцах и жире молока.
Теперь понятна важность кормления младенцев грудным молоком в первые месяцы жизни.
Такой себе незаметный и незаменимый кирпич мироздания.
Роль арахидоновой кислоты
Считается наиболее важной из всех Омега-6. Из нее производятся простогландины и лейкотриены – активные вещества, играющие важную роль в физиологии.
- Обеспечивает рост и восстановление мышц, что дает основание причислять ее к анаболикам. И бодибилдеры это знают.
- Регулирует кровообращение, расширение и сужение сосудов, сосудистые и другие реакции в местах воспаления, выработку кислоты и слизи в желудке.
- Управляет воспалениями и передает соответствующие сигналы от клеток.
- Участвует в работе почек, желудочно-кишечного тракта, в обеспечении здоровья кожных покровов.
Куда ни кинь – всюду арахидоновая кислота, польза которой лежит на поверхности.
Арахидоновая кислота и витамин F
Совместно с другими «омегами» входит в витамин F, полезная роль которого, кроме указанной выше, сводится к участию в жировом и холестериновом обмене, укреплению иммунитета и костей, производству спермы и ряду других.
Источники арахидоновой кислоты
В сутки взрослому человеку нужно до 10 г полиненасыщенных жирных кислот, из которых половина должна приходиться на арахидоновую.
Кстати, из двух единиц линолевой кислоты в организме синтезируется единица арахидоновой. Наиболее богатый их источник – свиное сало. И в том числе за это оно так высоко ценится не только гурманами, но и истинными ЗОЖовцами (узнайте, за что любят ).
Правда, не стоит пытаться набрать все Омега-6 только из него, иначе придется за день съедать по четверти килограмма «жирного наркотика». О последствиях такой диеты говорить не стоит – на них красноречиво укажут утолщившиеся бока.
- говяжья печень – 3 грамма на килограмм;
- сырые яйца – 4 г;
- бараньи почки – 5 г;
- сырое куриное бедро, утка, лосось – 1 г;
- сырая куриная и индюшачья грудка, говядина – до 6 г.
Долго искать другие ее источники не нужно, потому что на помощь приходят растительные масла, богатые на линолевую кислоту ( ?).
Наиболее насыщенные по Омега-6 из доступных масел – подсолнечное (66%) и кукурузное (54%). Меньше 20 грамм масла в день полностью покрывают нашу потребность.
Хотя слишком усердствовать не стоит, потому что переизбыток приведет к нехорошим последствиям.
Переизбыток Омега-6
Вот мы и подошли к противоречивому моменту, показывающему, что наш герой превращается в антигероя, когда его слишком много.
Чем грозит «передоз»:
- густая кровь с соответствующими нехорошими последствиями;
- депрессия;
- преследующие воспаления и кожные высыпания.
Выводы
Мало ее – плохо, слишком много – тоже плохо. Только норма хороша.
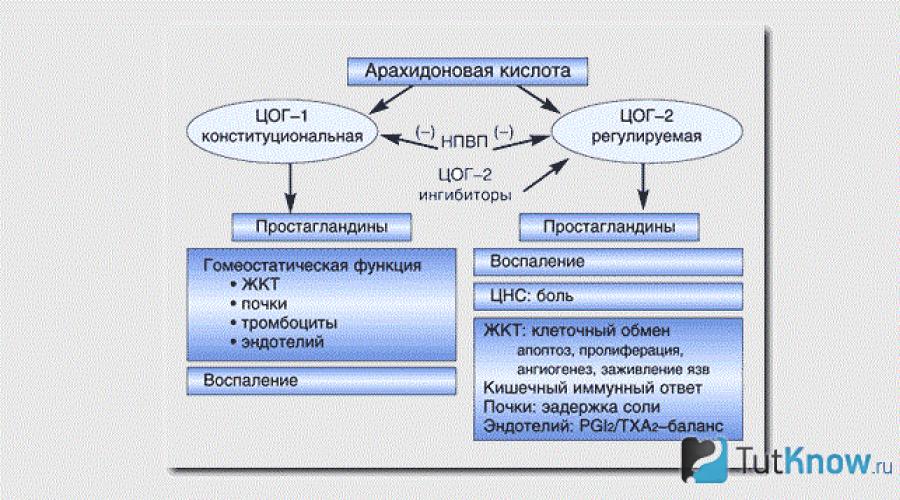
Обсуждая роль тромбоцитов в патогенезе артериального тромбоза, необходимо упомянуть о 2 прямо противоположных по своему действию на тромбоциты и гладкую мускулатуру веществах: тромбоксане А 2 и простациклине. Оба соединения -J конечные продукты метаболизма арахидоновой кислоты.
Арахидоновая кислота - предшественник всех классов простагландинов (PG). Синтез арахидоновой кислоты в организме осуществляется из фосфолипидов под действием фосфолипазы. Основной источник арахидоновой кислоты - ненасыщенные жирные кислоты, поступающие в организм с пищей. Превращение арахидоновой кислоты в организме осуществляется под действием 2 ферментов: липооксигеназы и циклооксигеназы. ПоМ действием циклооксигеназы из арахидоновой кислоты образуются циклические эндоперекиси PGG2 и Н2, которые в дальнейшем превращаются в тромбоксан А2 и простациклин, PGD2, Е 2 , F 2 a / Тромбоксан А2, образующийся под действием фермента тромбоксансинтетазы, - нестабильное соединение (t1/2 составляет около 30 с), он быстро превращается в стабильный продукт тромбоксан В2. Тромбоксан А2 образуется в тромбоцитах и выделяется в кровоток в процессе реакции освобождения, ордгкЛ было установлено, что небольшие количества тромбоксана А2> образуются в эндотелии внутренней оболочки аорты, а также в фибробластах легочной ткани, микросомах радужной оболочки глаза, в перфузируемой почке, пупочной артерии, плаценте; в малых количествах он образуется практически во всех сосудах человека. Тромбоксан А 2 - мощный проагрегант и вазоконстриктор.
ПРОСТАГЛАНДИНЫ
Простагландины образуются из ненасыщенных жирных кислот. Количество ненасыщенных связей в молекуле простагландинов обозначают цифрой, стоящей справа внизу от названия: ПГ^ ПГ2, ПГ3. Их подразделяют также на группы: А - ненасыщенные кетоны, Е - оксикетоны, F - 1,3-диолы.
Биосинтез простагландинов начинается с отщепления арахидоновой кислоты от мембранного фосфолипида или диацил-глицерина. Эту реакцию катализирует фосфолипаза А2, липаза моноацилглицерина или липаза триглицеридов.
Циклооксигеназа при участии О2 преобразует арахидоновую кислоту в эндоперекись, из которой образуется целое семейство простагландинов (рис. 3.11).
Эндоперекиси, образующиеся в процессе биосинтеза простагландинов, обладают высокой биологической активностью в опытах in vitro, но едва ли влияют на клетки in vivo, так как очень неустойчивы - период их полужизни равен менее 1 с. Простагландин-синтетазный комплекс представляет собой полиферментную систему, функционирующую на мембранах эн-доплазматического ретикулума. Образующиеся простагландины проникают в плазматическую мембрану клетки. Они могут выходить из клетки и через межклеточное пространство переноситься на соседние клетки или проникать в кровь и лимфу.
Лимитирующим этапом в биосинтезе простагландинов является высвобождение арахидоновой кислоты, которое происходит при повышении в цитоплазме клетки ионов Са 2+ или цАМФ. Благодаря этому все гормоны и нейромедиаторы, активирующие аденилатциклазу или повышающие концентрацию Са 2+ в клетке, могут стимулировать синтез простагландинов. Другой причиной образования простагландинов под действием многих гормонов и факторов роста является то, что эти биологически активные вещества стимулируют образование диацилглицерина - источника арахидоновой кислоты.
Простагландины группы Е могут активировать аденилатцик-лазу, a F - увеличивать проницаемость мембран для Са 2+ . Поскольку цАМФ и Са 2+ стимулируют синтез простагландинов, замыкается положительная обратная связь в синтезе этих специфических регуляторов.
Во многих тканях кортизол тормозит высвобождение арахидоновой кислоты, тем самым подавляя образование простагландинов. Именно этим принято объяснять противовоспалительное действие глюкокортикоидов. Простагландин Ei является мощным пирогеном. Подавлением синтеза этого простагландина объяс няют терапевтическое действие аспирина, который ингибирует циклооксигеназу, вызывая ее ацетилирование.
Период полужизни простагландинов составляет 1-20 с. У человека и большинства млекопитающих основной путь инактивации простагландинов - это окисление 15-гидроксигруппы до соответствующего кетона. Данную реакцию катализирует 15-гидрокси-простагландин-дегидрогеназа - фермент, который есть практически во всех тканях, но в наибольшем количестве содержится в легких. Окисление ОН-группы в положении 15 приводит к инактивации молекулы, поэтому кровь, прошедшая через легкие, полностью лишена биологически активных простагландинов.
Дальнейшая деградация простагландинов происходит путем восстановления двойной связи (в положении 13-14), р-окисления СООН-конца и со-окисления СНз-конца молекулы. После этого образуется 16-углеродная дикарбоновая кислота, которая выводится из организма.
Простациклин образуется в эндотелиальных клетках сосудов под действием фермента простациклинсинтетазы. 1\/2 составляет 2-3 мин. Простациклин имеет несколько стабильных метаболитов, основной из которых - 6-KeToPGFi a . Полагают, что его содержание отражает содержание простациклина в плазме крови. Простациклин - мощный системный вазодилататор и ан-тиагрегант. Последнее обусловлено активацией в мембране тромбоцитов аденилатциклазного механизма, приводящего к увеличению в тромбоцитах содержания цАМФ, уменьшению свободного цитоплазматического кальция и снижению агрегационной способности тромбоцитов. Простациклин - вещество, образующееся in situ. Импульсом к образованию простациклина эндоте-лиальными клетками могут быть повреждение целостности эндотелия, а также появление в кровотоке тромбина. При адгезии тромбоцитов к месту поврежденного сосуда из них выделяется тромбоксан, одновременно с этим из эндотелиальных клеток выделяется простациклин, ограничивая или предотвращая процесс тромбообразования.
Известно, что серозные оболочки, в том числе и перикард, образуют простациклиноподобные субстанции, причем простациклин, содержащийся в перикардиальной жидкости, способен влиять на коронарный кровоток. С возрастом при развитии атеросклероза синтез простациклина сосудистой стенкой снижается.
ТРОМБОКСАН
С появлением исследований Монкада и Вейна, посвященных метаболитам арахидоновой кислоты, в начале 70-х годов начался период активного изучения роли тромбоксана и простациклина в патогенезе коронарного спазма и тромбоза. В конце 70-х и 80-х годах была опубликована серия исследований, посвященных роли дисбаланса в соотношении тромбоксан/простациклин в патогенезе коронарного тромбоза и спазма. Результаты показали, чт« у больных стенокардией во время ишемии миокарда, вызванной стимуляцией предсердий, в крови, оттекающей непосредственно от миокарда, повышается содержание тромбоксана В 2 . Кроме того, было показано, что при отсутствии различий в покое у здо-| ровых и больных стенокардией в содержании тромбоксана и 6-KeToPGFi a по реакции на физическую нагрузку больные ИБС отличаются от здоровых преобладанием выброса тромбоксана и снижением выброса простациклина. Эти данные позволили группе исследователей во главе с Мехта выдвинуть гипотеза о роли дисбаланса в соотношении тромбоксан/простациклин в изменении сосудистого тонуса и происхождении ишемии миокарда. В дальнейшем появились данные о повышении содержания тромбоксана в крови, оттекающей непосредственно от миокарда (из коронарного синуса), у больных нестабильной стенокардией (Хирш и соавт., 1981) и во время индуцированной ишемии миокарда (Леви и соавт., 1980). Огромный интерес вызывали работы Мехта и соавт. (1984), Робертсона и соавт. (1981, 1983), продемонстрировавшие нарастание содержания тромбоксана В 2 в крови коронарного синуса во время спонтанных приступов у больных с вазоспастической формой стенокардии." По мнению авторов, увеличение содержания тромбоксана определяло коронарный тонус и способствовало возникновению и усугублению ишемии. Высказывалась гипотеза, что происхождение приступов вазоспастической стенокардии может быть связано с активацией тромбоцитов, выбросом тромбоксана и быстрым образованием тромбоцитарного тромба в месте спазма коронарной артерии. Однако последующие исследования, проведенные у больных со спонтанной ишемией миокарда и взятием крови из коронарного синуса за несколько минут до возникновения 1 приступа стенокардии, показали, что увеличение концентрации* тромбоксана в момент приступа вторично по отношению к спазму и ишемии миокарда, а кроме того, угнетение синтеза тромбок- сана с помощью аспирина, индометацина не уменьшало частоту эпизодов ишемии у больных вазоспастической стенокардией.
Лейкотриены являются медиаторами аллергических и воспалительных процессов. Лейкоциты являются одним из главных источников лейкотриенов. При окислительном метаболизме AA под действием фермента 5-липоксигеназы образуется нестабильное соединение - лейкотриен A . Это промежуточное соединение является субстратом для двух различных ферментов: лейкотриен А-гидролазы и лейкотриен С4-синтазы, дающих LTB4 и LTС. Далее под действием глутаминил-трансферазы LTС4 превращается в лейкотриен LTD . Затем лейкотриен LTD4 под действием пептидазы превращается в лейкотриен LTE . Лейкотриены могут быть подразделены на два класса в зависимости от их химической структуры и биологической активности
Лейкотриены образуются в результате окислительного метаболизма арахидоновой кислоты путем действия 5-липоксигеназы (EC 1.13.11.34), которая приводит к нестабильному лейкотриену А 4 , содержащему аллильный эпоксид.
Этот промежуточный лейкотриен служит субстратом для двух различных специфических ферментов: лейкотриен А 4 -гидролазы и лейкотриен С 4 -синтазы, которые катализируют образование лейкотриена В 4 и цистеинил-лейкотриенов соответственно.
Название "лейкотриены" отражает их происхождение из клеток (лейкоциты - один из главных источников), а также наличие в структуре триеновой системы [ Samuelsson, В., Borgeat, P., ea., 1979 ].
Лейкотриены могут быть подразделены на два класса в зависимости от их химической структуры и биологической активности:
а) цистеинил-лейкотриены, а именно лейкотриен C4 , лейкотриен D4 и лейкотриен Е4 , содержащие различные аминокислотные остатки, и
б) лейкотриен В4 - дигидроксикислоту
Лейкотриены С4 и D4 являются активными контрактильными агентами гладкой мускулатуры дыхательных путей и сосудов, кроме того, они могут вызывать секрецию слизи и усиливать плазматическую эксудацию прямым воздействием на эндотелиальные клетки.
С другой стороны, лейкотриен В4 известен как активный хемокинетический и хемотактильный агент. Ряд опубликованных данных подчеркивает потенциальную роль лейкотриенов в воспалительных процессах, характерных для астмы и других патологических состояний. Эти активные липидные биоэффекторы синтезируются в ходе воспалительных реакций и их фармакологическая модуляция может существенно изменять клиническую картину, ассоциированную с различными воспалительными патологиями.
Синтез лейкотриенов в основном происходит при аллергических реакциях немедленного типа и начинается после связывания антигена с IgE , фиксированными на поверхности этих клеток. При этом свободная арахидоновая кислота под действием 5-липоксигеназы превращается в лейкотриен A4 , из которого затем образуется лейкотриен В4 . При конъюгации лейкотриена В4 с глутатионом образуется лейкотриен С4 . В дальнейшем лейкотриен С4 превращается в лейкотриен D4 , из которого, в свою очередь, образуется лейкотриен Е4 (рис. 2.3).
Лейкотриен В4 - первый стабильный продукт липоксигеназного пути метаболизма арахидоновой кислоты. Он вырабатывается тучными клетками, базофилами, нейтрофилами, лимфоцитами и моноцитами. Это основной фактор активации и хемотаксиса лейкоцитов в аллергических реакциях немедленного типа.
Лейкотриены С4, D4 и Е4 раньше объединяли под названием "медленно реагирующая субстанция анафилаксии", поскольку их высвобождение приводит к медленно нарастающему стойкому сокращению гладких мышц бронхов и ЖКТ. Ингаляция лейкотриенов С4 , D4 и Е4 , как и вдыхание гистамина, приводит к бронхоспазму. Однако лейкотриены вызывают этот эффект в 1000 раз меньшей концентрации. В отличие от гистамина, который действует преимущественно на мелкие бронхи, лейкотриены действуют и на крупные бронхи. Лейкотриены С4, D4 и Е4 стимулируют сокращение гладких мышц бронхов, секрецию слизи и повышают проницаемость сосудов.
Биологическое действие Cys-LTs осуществляется через специфические мембранные рецепторы. Рецептор Cys-LT1 и рецептор Cys-LT2 были охарактеризованы фармакологически (см. обзор [ Metters, K.M. 1995 ]).
Антагонисты рецепторов, разработанные на основе структуры LTD4, в основном блокируют эффекты, опосредованные Cys-LT1-рецептором, который, по-видимому, ответствен за сокращение изолированных бронхов человека.
Активация Cys-LT#1-рецептора, как полагают, связана с двумя типами G-белков (чувствительных и нечувствительных к действию коклюшного токсина) и вызывает мобилизацию внутриклеточного кальция различными способами [ Chan, C.C., Ecclestone, P., ea., 1994 , Howard, S., Chan-Yeung, M., ea., 1992 ].
/ / / / ЛЕЙКОТРИЕНЫ (LT), производные полиеновых кислот, содержащие в молекуле три сопряженные двойные связи, а также (наряду с др. заместителями) гидроксигруппу в положении 5 или эпоксигруппу в положении 5,6; выполняют ф-ции прир. биорегуляторов. Известно 6 типов лейкотриены - А, В, С, D, Е и F (см. ф-лы I-III, Glu - остаток глутаминовой кислоты, Gly - глицина).
Внутри каждого типа различают три серии лейкотриены , отличающиеся числом двойных связей (обозначают цифрами 3,4, 5 или 6 в ниж. индексе - в зависимости от числа двойных связей). Большинство лейкотриены - нестабильные соед., и, как правило, их можно охарактеризовать только в виде производных. Так, для метилового эфира LTA 4 т. плейкотриены 28-32 °С, [a] D 20 -27° (гексан). Все лейкотриены имеют характерный УФ спектр с тремя максимумами поглощения, например для спектра LTB 4 в метаноле l макс 260 (e 3,8.10 4), 270,5 (e 5,0.10 4) и 281 нм (e 3,9.10 4), для LTC 4 l макс 270 (e 3,2.10 4), 280 (с 4,0.10 4) и 290 нм (e 3,1.10 4) В организме животных обнаружены структурные изомеры лейкотриены - т. наз. липотриeны (см., например, ф-лу IV). В отличие от лейкотриены они содержат гидроксигруппу в положении 15 или эпоксигруппу в положении 14, 15. Принципиально новый класс метаболитов эйкозаполиеновых кислот, родственных лейкотриены , - липоксины, имеющие в молекуле 4 сопряженные двойные связи и 3 гидроксигруппы (V-VI). Серосодержащиe (пептидные) лейкотриены (LTC 4 и др.) образуются в разлейкотриены нормальных и трансформированных клетках млекопитающих (лейкоцитах, моноцитах, макрофагах, в базофилах крыс, больных лейкемией и др.). Более широко распространены лейкотриены типов А и В. Они найдены не только у животных, но и в некоторых растениях, например картофеле. лейкотриены не накапливаются в тканях, а синтезируются в ответ на определенные стимулы. Они участвуют в воспалит. реакциях и являются медиаторами анафилаксии (аллергической реакции немедленного типа, развивающейся в ответ на присутствие аллергена). Для пептидных лейкотриены более характерно миотропное действие (сокращение гладкой мускулатуры желудочно-кишечного тракта, бронхов, паренхимы легких, кровеносных сосудов). LTB 4 проявляет выраженное лейкотропное действие - вызывает агрегацию, хемотаксис (направленное движение) и хемокинезис (повышение подвижности) лейкоцитов - и является активным ионофором для Са 2+ . Установлено, что в ряде случаев физиолейкотриены действие лейкотриены опосредовано их взаимодействием со специфич. рецепторами. Липоксины стимулируют хемотаксис лейкоцитов и агрегацию тромбоцитов. Биосинтез лейкотриены , липотриенов и липоксинов осуществляется через промежут. реакционноспособные гидропероксиды (соотв. через 5- или 15-гидропероксиэйкозаполиеновые и 5,15-дигидропероксиэйкозаполиеновые кислоты), которые образуются в результате окисления эйкозаполиеновых кислот при участии 5- или (и) 15-лилооксигеназ. Моногидропероксиэйкозаполиеновые кислоты далее превращаются в нестабильный эпоксид типа А, из которого образуются лейкотриены др. типов. Осн. путь катаболизма лейкотриены - их w-окисление с образованием 20-гидрокси- и 20-нор-19-карбоксипроизводных. В лаб. условиях лейкотриены получают из полиеновых кислот с использованием ферментативных реакций или синтезируют с помощью реакции Виттига, осуществляя конденсацию углеводородного и карбоксилсодержащего фрагментов. Для количеств. определения лейкотриены обычно используют высокоэффективную жидкостную хроматографию и радиоиммунный анализ (используются меченные радиоактивными атомами антигены). Вследствие важной роли лейкотриены в патогенезе таких заболеваний, как бронхиальная астма, проводится интенсивный поиск лек. ср-в, блокирующих биосинтез лейкотриены или их рецепторов. Лит.: Будницкая Е, В., "Успехи биологической химии", 1985, т. 26, с. 269-77; Евстигнеева Р. П.. Мягкова Г. И.. "Успехи химии". 1986. т. 55. в. 5. с. 843-78; Современные направления в органическом синтезе, пер. с англейкотриены , М.. 1986, с. 12-28; Leukotrienes and other lipoxygenase products, ed. by P. Samuelsson, R. Paoletti, N. Y.. 1982; Schewc Т., Rapoport S. M., Kuhn H., в сб.: Advances in enzymology and related areas of molecular biology, v. 58. 1986, p. 191-272; Kuhn H. , "Europ. J. Biochem.". 1987, v. 169, № 3, p. 593-601. В. В. Безуглов. В. 3. Ланкин.
Лекция 4. Биологически активные пептиды и гормоны сердца.
4.1.Кинин-калликреиновая система. Синтез, распад, механизм действия кининов на сосуды.
4.2.Ренин-ангиотензиновая система. Синтез, распад, механизм действия ангиотензина II на сосуды.
4.3.0бшая характеристика гормонов сердца.
Строение и номенклатура кининов и других компонентов каликреин-кининовой системы (ККС)
Термином "кинины" обозначается группа нейровазоакгивных полипептидов, содержащих как минимальную структурную единицу линейный нонапептид БК. Поскольку в организме человека и млекопитающих кинины в свободном состоянии практически не встречаются (за исключением мочи), а образуются в крови и тканях из неактивных предшественников, эти пептиды, а также образующие и разрушающие их ферменты объединяют в ККС (Erdos, 1976).
БК образован пятью аминокислотами, имеющими L-конфигурацию: серином, глицином, фенилаланином, пролином и аргинином (Apr). Характерной особенностью БК является наличие остатков Apr на N- и С-концах полипептидной цепи, придающих ему свойства основания (изоэлектрическая точка находится при рН 10,0). Наличие трех остатков пролина обусловливает необычно жесткую конформацию фермента молекулы БК и отсутствие α-спиральной конфигурации. Изучение конформационного состояния БК в растворах показало, что в диапазоне рН 2-8 БК имеет циклическую конформацию за счет ионогенных групп (Apr 1 и Apr 9), расположенных на противоположных концах молекулы.
Для проявления биологической активности БК необходимо наличие двух концевых остатков Apr, включающих свободные гуанидиновые группы, замена которых, например на нитрогруппы, снижает активность БК в 100 раз.
Наряду с БК и каллидином (представляющим собой 10-членный полипептид, содержащий дополнительную группировку лизина, Лиз-БК), из плазмы крови млекопитающих выделен образованный 11 аминокислотами метионил-лизил-брадикинин (Мет-Лиз-БК). Биологической активностью обладает и октапептид дес-Арг 9 -БК, который в определенных условиях образуется в организме человека и животных из БК.
Существует также ряд веществ пептидной структуры, выделенных из земноводных, насекомых и моллюсков (физалемин и др.), которые по характеру биологического действия относят к кининам ("пахикинины").
Согласно номенклатуре ККС (Webster, 1966), субстраты, из которых кинины образуются, названы кининогенами, ферменгы, образующие кинины, - кининогеназами (калликреинами), а предшественники - прекалликреинами. Ферменты, разрушающие кинины, называют кининазами.
Метаболизм кининов
В организме человека и млекопитающих кинины образуются из неактивных предшественников - кининогенов, находящихся в плазме крови, лимфе, межтканевой жидкости и тканях. Кининогены, представляющие собой кислые гликопротеиды, существуют в двух видах: а) низкомолекулярный кининоген (НМК) и б) высокомолекулярный (ВМК). НМК является основным источником кининов в тканях; его мол. м. составляет около 70 ООО (у человека). ВМК присутствует главным образом в плазме крови, где из него образуются кинины; его мол. м. составляет 120 ООО (у чел.).
Главное отличие НМК от ВМК состоит в отсутствии у первого большого фрагмента полипептидной цепи ("гистидин-богатого пептида"), необходимого ВМК для реализации его прокоагулянтной активности.
Образование кининов (БК, Лиз-БК) происходит при взаимодействии кининогенов с активированными кининообразующими ферментами - калликреинами . В физиологических условиях реакции кининообразования протекают строго согласованно между собой и обеспечивают генерализованное или местное образование кининов в определенных и при этом в весьма малых количествах (в норме концентрация кининов в плазме крови составляет 0,01-3,0 нг/мл): Узкая субстратная специфичность калликреинов обусловливает их взаимодействие с соответствующими субстратами, при этом плазменные калликреины (К.Ф.3.21.34) проявляют высокое сродство к ВМК, а тканевые (К.Ф.3.21.35) - к НМК.
Активность ККС, реализующей свои функции путем образования кининов, регулируется, с одной стороны, сложным механизмом естественных ингибиторов калликреина, а с другой - действием инактивирующих кинины ферментов - кининаз . Эндогенные ингибиторы калликреинов, обнаруженные в крови и тканях человека и животных, существенно различаются как по строению, так и по специфичности действия.
В плазме крови обнаружены три ингибитора калликреина: С1-ин-активатор, а 2 -макроглобулин и комплекс антитромбина III с гепарином.
Другим важным механизмом, регулирующим активность ККС, является инактивация кининов, осуществляемая кининоразрушаюшими ферментами. Наибольшее значение в процессах инактивации кининов имеют кининазы, разрушающие пептидные связи на карбоксильном конце молекул БК и Лиз-БК (каллидина). Среди них, в свою очередь, важную роль играют два металлофермента - кининаза I и II , которые имеют некоторые сходные свойства, но различную локализацию в организме и различные точки действия в молекуле кининов.
Кининаза I, или карбоксипептидаза N (К.Ф.3.4.12.7), является экзопептидазой, отщепляющей С-терминальный остаток Apr от молекул БК и Лиз-БК, в результате чего образуется дес-Арг 9 -БК и дес- х Арг 10 -Лиз-БК - два метаболита кининов, потенциально обладающих биологической активностью. Кининаза I представляет собой большой белок с мол. м. около 280 ООО, активный не только по отношению к кининам, но и к СЗа анафилатоксину и другим пептидам, имеющим остатки Apr и Лиз на карбоксильном конце молекулы. Фермент чувствителен к рН среды. В кислой среде (рН 2-3) он необратимо инактивируется; в буферных растворах максимум его активности проявляется при рН 7-7,5.
Другим ведущим кининоразрушающим ферментом, который также осуществляет инактивацию кининов по карбоксильному концу молекулы, является кининаза II (К.Ф.3.4.15.1). Этот фермент, называемый также дипептидил-карбоксипептидазой (ДКП) и карбоксикатепсином , отщепляет дипептидный фрагмент Фен 8 -Apr 9 от молекулы БК и таким образом полностью инакгивирует этот пептид. В отличие от циркулирующей в крови кининазы I, кининаза II является мембрано-связанным ферментом и локализована на мембранах эндотелиальных клеток, выстилающих внутреннюю поверхность сосудов. В связи с этим особенно высокие концентрации данного фермента обнаружены в органах с обильной васкуляризацией: в легких, почках и др. Характерной особенностью кининазы II (ДКП) является способность гидролизовать вторую пептидную связь при карбоксильном конце молекул ряда пептидов, в том числе кининов. Благодаря этому свойству фермент отщепляет дипептидные фрагменты от молекул не только БК, но ангиотензина I, Лей- и Мет-энкефалинов.
Быстрая инактивация БК и Лиз-БК кининазами I и II определяет кратковременность действия кининов в организме. Период полусуществования БК и Лиз-БК в крови собак составляет 0,27 и 0,32 мин соответственно. Близкие данные были получены в опытах на кошках. Инактивация кининов в значительной степени происходит в легких. От 80 до 90 % биологической активности Б К устраняется за несколько секунд его прохождения через сосуды малого круга кровообращения.
Особый интерес как с теоретической, так и с практической точки зрения представляют данные об идентичности кининазы II (ДКП) ангиотензин I-превращающему ферменту, катализирующему превращение биологически малоактивного ангиотензина I в активный прессорный октапептид ангиотензин II . Таким образом, ДКП является ключевым ферментом, который осуществляет регуляцию активности двух нейрогуморальных систем организма - ККС и ренин-ангиотензиновой (РАС) (В.Н. Орехович и соавт., 1984).
Значительно меньший, чем кининазы I и II, вклад в инактивацию кининов вносят другие кининоразрушающие ферменты: карбоксипептидаза В и химотрипсин, эндопептидаза, выделенная из мозга кроликов, аминопептидаза плазмы крови . Причем последний фермент отщепляет Лиз 1 в молекуле Лиз-БК (каллидина) и дипептид Арг"-Про 2 в молекуле Мет-Лиз-БК, но не действует на связь AprMlpo 2 в молекуле БК.
Рассматривая метаболизм кининов в целом, следует отметить, что эти полипептиды присутствуют в крови и тканях в весьма низких концентрациях, являющихся следствием равновесия, наблюдаемого между многоступенчатыми процессами их образования и инактивации. Внутренние и внешние факторы, запускающие каскад энзиматических реакций кининообразования путем активирования калликреина плазмы крови или тканевых калликреинов, вызывают образование кининов, концентрация которых в крови и тканях регулируется весьма эффективными механизмами эндогенных ингибиторов калликреинов и кининаз, быстро и полно инактивирующих эти пептиды. Таким образом, осуществляемая энзиматическими механизмами саморегуляция активности ККС.
Эффекты кининов
Сердечно-сосудистая система
При внутрисосудистом (внутривенном или внутриартериальном) введении кинины вызывают кратковременное понижение системного АД, увеличение скорости местного и общего кровотока, расширяют сосуды (в основном артериолы), понижают периферическое сопротивление, повышают тонус вен, частоту и силу сердечных сокращений, увеличивают проницаемость микрососудов, изменяют микроциркуляцию.
Вызываемое БК и другими кининами понижение АД наблюдается как у людей, так и у различных видов лабораторных животных, в связи с чем кинины называют "гипотензивными пептидами". Пороговая доза БК, вызывающая снижение АД, составляет 0,02-4 мкг/кг. Наиболее чувствительны в этом отношении кролики и собаки. Гипотензивный эффект БК носит дозазависимый характер, а его выраженность зависит от пути введения - в артериальное или венозное русло.
В механизме гипотензивного действия кининов следует учитывать понижение периферического сопротивления, а также перераспределение кровотока (в сердце, почках, печени, мышцах, кишечнике и др.) и изменения кровообращения в микроциркуляторном русле.
Одним из значимых свойств кининов является их влияние на микроциркуляцию. Анализ микроциркуляторных эффектов кининов показывает, что внутрисосудистое или внутрикожное их введение вызывает быстрое расширение артериол и повышение давления в капиллярах и венулах. При этом благодаря особенностям строения стенки микрососудов наблюдается сокращение выстилающих их внутреннюю поверхность эндотелиальных клеток и расширение межэндотелиаль-ных щелей ("округление" клеток).
Таким образом, в концентрациях, превышающих физиологические, кинины создают условия, которые способствуют выходу жидкой части крови с растворенными в ней веществами, включая белки, в экстравазальное пространство. Эффлюкс жидкости из крови в ткани ведет к формированию отека, что и наблюдается при патологических состояниях.
Гладкомышечные органы
Второй точкой приложения действия БК, Лиз-БК и других кининов в организме является внесосудистая гладкая мускулатура. БК и Лиз-БК (каллидин) вызывают характерное медленное (в отличие от АХ, гистамина или серотонина, вызывающих быстрое повышение тонуса гладких мышц) сокращение или расслабление различных изолированных тест-объектов: матки крысы, подвздошной кишки морской свинки, тощей и подвздошной кишки, двенадцатиперстной и толстой кишки крысы и др. Указанные эффекты кинины вызывают уже начиная с концентрации 1-10 -10 -1-10 -9 г/мл. Перечисленные изолированные органы являются высокочувствительными тест-объектами к действию БК и Лиз-БК и широко используются в фармакологических экспериментах, а также для количественного определения кининов.
В связи с тем, что матка крысы и тонкий кишечник морских свинок реагируют также и на ряд других агонистов - АХ, гистамин, серотонин, простагландины (ПГ), для проведения указанных выше определений используют в качестве тест-объекта и подвоздушную кишку кошки, отличающуюся большей чувствительностью и избирательностью к действию кининов.
Некоторые органы, например двенадцатиперстная кишка крысы, реагируют на стимуляцию БК расслаблением. У интактных животных действие кининов на экстравазальную гладкую мускулатуру, как правило, выражено слабее, чем в условиях изоляции гладкомышечных органов из организма. Исключение составляет бронхоконстрикгорная реакция, развивающаяся у морских свинок при внутривенном введении БК в дозах 5-25 мкг/кг.
Периферическая нервная система
Важным свойством кининов является способность вызывать болевые ощущения у человека и животных при разных способах введения. При этом вызывающие болевой эффект дозы БК во много раз меньше эквиэффективных альгетических доз АХ и гистамина.
В относительно высоких концентрациях (210~ 5 -510~ 5 г/л) БК вызывает раздражение окончаний периферических афферентных нервов, болевую реакцию и повышение АД у ненаркотизированных животных. В 1000-5000 раз меньших концентрациях БК сенсибилизирует нервные окончания к болевому действию К + . Интересно отметить, что при предварительной сенсибилизации БК пороговые концентрации К + , необходимые для болевого возбуждения афферентных волокон, снижаются до величин, определяемых в очаге воспаления.
У ненаркотизированных животных внутривенное или внутрикожное введение БК сопровождается характерной для болевого раздражения афферентной импульсацией, вокализацией, двигательной реакцией, рефлекторным повышением АД.
Центральная нервная система
Компоненты ККС (в частности, кининообразующие и кинино-разрушающие ферменты), а также БК-подобные соединения обнаружены в мозге крыс и кроликов. Внутрижелудочковое введение БК кошкам вызывало расстройства походки и координации движений, вокализацию, учащение дыхания и мидриаз. При введении в боковые желудочки мозга мышам БК в дозе 8 мг на 20 г массы тела кратковременно повышал двигательную активность с последующим наступлением ступорозного состояния. В указанных экспериментах БК снижал величины пороговых доз коразола, стрихнина и электрического раздражения, необходимые для получения судорожной реакции.
Стимулирующий компонент связан с действием самого БК, тогда как тормозная фаза вызывается фрагментами его молекулы, образующимися в результате разрушения кинина кининазами мозга.
ККС функционирует в тесном взаимодействии с рядом других нейрогуморальных систем организма, это взаимодействие осуществляется как на биохимическом, так и на физиологическом уровнях.
Между реакциями, обеспечивающими образование кининов в плазме крови, и реакциями гемокоагуляции существуют тесные взаимосвязи. В указанных реакциях принимают участие четыре общих компонента: факторы XII и XI системы свертывания крови, прекал-ликреины и ВМК. В присутствии отрицательно заряженной поверхности фактор XII активирует прекалликреины в калликреин, который, в свою очередь, активирует фактор XII в фактор ХНа (фактор Хагемана). Затем фактор -ХНа активирует прекалликреин и фактор XI, причем более эффективно, чем фактор XII. ВМК существенно ускоряет и усиливает реакции активации фактора XII и прекалликреина в присутствии отрицательно заряженной поверхности за счет взаимодействия с ней входящих в его состав легких цепей. Активаторами указанных реакций являются не только каолин, но и различные сульфатированные полисахариды (сульфат амилазы, декстран сульфат, сульфат целлюлозы и др.). В организме имеет место тесное взаимодействие между системами свертывания крови и ККС, что, по-видимому, весьма существенно для связывания текучести крови с тонусом и проницаемостью сосудов. Указанные взаимосвязи схематически представлены на рис. 19.
Весьма тесное взаимодействие существует между ККС плазмы крови и почек и РАС. ККС почек и РАС функционируют практически как единая система из-за ключевой роли, которая принадлежит кини-назе II (ДКП, ангиотензин 1-превращающий фермент) в метаболизме кининов и ангиотензина I. Обе катализируемые этим ферментом реакции - инактивация БК и превращение малоактивного ангиотензина I в обладающий высокой биологической активностью ангиотензин II - регулируют уровень АД, а также баланс электролитов и воды в организме. В физиологическом плане ККС и РАС являются антагонистами и оказывают разнонаправленное действие на тонус сосудов и АД, а также функции почек и других органов.
Часть биологических эффектов кининов реализуется через активацию биосинтеза ПГ. Известно, что эндогенные пептиды повышают продукцию ПГ; в этом отношении БК занимает ведущее место. В экспериментах на изолированных легких кролика и почках собаки, а также на целых животных БК способствовал образованию ПГ, в том числе простациклина и тромбоксанов. Ингибиторы биосинтеза ПГ - нестероидные противовоспалительные препараты (ацетилсалициловая кислота, индометацин) уменьшали указанное действие БК. Интересно, что индометацин снижает и укорачивает дбпрессорный эффект БК у крыс.
Механизм влияния кининов на образование ПГ заключается в стимуляции ими фермента фосфолипазы А2, который катализирует превращение фосфолипидов клеточных мембран в начальный продукт метаболизма ПГ - арахидоновую кислоту.
Кинины не только усиливают биосинтез ПГ, но и участвуют в их метаболизме, активируя ферменты ПГЕ-9-кеторедуктазу, превращающую ПГЕ2 в ПГ?2 альфа. В свою очередь ПГ способны стимулировать кининогенез.
В последнее время показано, что продукты липоксигеназного пути метаболизма арахидоновой кислоты - лейкотриены В4, С4, D4 уменьшают некоторые эффекты Б К.
В литературе имеются данные о взаимодействии кининов и прочих компонентов ККС с некоторыми другими биогенными системами организма. Так, кининаза II (ДКП) принимает участие в метаболизме эндогенных опиоидных пептидов - энкефалинов. БК и дес-Арг 9 -БК высвобождают катехоламины из тканевых депо в надпочечниках и симпатических ганглиях. В свою очередь, катехоламины (адреналин и норадреналин), а также стимуляция симпатических нервов, при которой наблюдается выброс катехоламинов, повышают кининообразова-ние на фоне снижения уровня кининогена (опыты на крысах и собаках).
Гистамин и серотонин также стимулируют кининогенез. В частности, показано, что гистамин при внутриартериальном введении увеличивает количество циркулирующего в крови БК; аналогичное действие оказывает и либератор гистамина и серотонина - вещество 48/80. С другой стороны, имеются данные с гистаминвысвобождающем действии БК при его взаимодействии с тучными клетками (крыс).
Молекулярные механизмы действия кининов
Анализ биологических эффектов кининов показывает, что большая часть из них связана с изменением тонуса сосудистой и вне-сосудистой гладкой мускулатура. Как уже было отмечено выше, одни из гладкомышечных органов реагируют на воздействие низких концентраций кининов сокращением, другие, наоборот, расслаблением. Различия в реакциях на кинины содержащих гладкомышечные элементы органов, разная их чувствительность к действию кининов, а также наличие фармакологических препаратов, способных менять их миотроп-ные эффекты, послужили основанием для гипотез о существовании в тканях специфических кининовых рецепторов различных типов.
Эффекты кининов на гладкую мускулатуру реализуются двумя основными механизмами: а) взаимодействием со специфическими тканевыми рецепторами и б) воздействием на активность ферментных систем, катализирующих образование и метаболизм ПГ.
Подобно пептидным гормонам, кинины взаимодействуют с определенными отрицательно заряженными участками клеточных мембран. Некоторые из образующихся при этом комплексов между кининами и участками мембраны (называемые рецепторами) запускают цепь функциональных, биохимических и биофизических реакций, ведущих к биологическому эффекту. По аналогии с другими рецепторными системами, можно полагать, что взаимодействие кининов с рецепторами предположительно состоит из двух фаз: а) связывания с рецептором (оккупации) и б) функционального изменения молекулы рецептора (активации). Указанные процессы не обязательно осуществляются одними и теми же химическими группировками молекулы пептида.
Существуют по крайней мере два различных типа тканевых рецепторов для кининов. Наряду с рецепторами в разных отделах ЖКТ, матки и сосудах, реагирующих на БК, Лиз-БК и ряд их аналогов (названных В2-рецепторами), в аорте кролика обнаружены рецепторы, высокочувствительные к дес-Арг 9 -БК - основному метаболиту, образующемуся в результате воздействия на БК кининазы I, получившие название В1-рецепторов.
Была выявлена высокая чувствительность рецепторов аорты кролика не только к дес-Арг 9 -БК, но и к Лиз-БК (каллидину). Повышение сродства кининов к В1-рецепторам наблюдается при снятии положительного заряда (Apr 9) с С-конца молекулы кинина (например, дес-Арг 9 -БК) и при усилении положительного заряда на N-конце пептида (Лиз-БК). Дополнительным доказательством в пользу существования специфических В1 рецепторов послужили свойства октапептида Лей 8 -дес-Арг 9 -БК, который является сильным конкурентным антагонистом действия кининов на В1-рецепторы (рА2=6,75) и неактивным в отношении В2-рецепторов.
Локализация рецепторов к кининам на поверхности ПМ эффекторных клеток свойственна и истинным пептидным гормонам. Например, будучи ковалентно связанным с полимерным носителем сефаро-зой, не способной проникать через ПМ, БК в полном объеме проявляет свою биологическую активность. Исследования, выполненные на изолированных ПМ миометрия и двенадцатиперстной кишки крыс, показали, что для БК и его аналогов на поверхности ПМ имеются специфические участки связывания. С кининовыми рецепторами могут связываться и кининоразрушающие ферменты, в частности кининаза II.
Как известно, существует определенная последовательность внутриклеточных реакций, развивающихся при связывании медиаторных веществ и пептидных гормонов с рецепторными белками, имеющая следствием биологический эффект (например, изменение тонуса гладких мышц). Среди ведущих промежуточных процессов, сопровождающих реакцию взаимодействия пептид-рецептор-эффекг, следует выделить изменение уровней циклических нуклеотидов (цАМФ и цГМФ) и Са 2+ . Для сократительных ответов эффекгорного органа характерен сдвиг соотношения внутриклеточного цАМФ/цГМФ в сторону повышения цГМФ, а для расслабляющего действия, наоборот,- в сторону увеличения уровня цАМФ. БК, являясь высокоактивным миотропным веществом, также меняет уровень внутриклеточных циклических нуклеотидов. В концентрациях 10 -11 -10 -8 М он повышает активность аденилатциклазы во фракции ПМ двенадцатиперстной кишки крысы, реагирующей расслаблением на воздействие этого пептида.
Следующим за изменением уровня циклических нуклеотидов этапом реализации миотропного эффекта кининов является изменение концентрации Са 2+ в клетке. Ионизированный Са 2+ устраняет тормозное влияние тропонин-тропомиозиновой системы на сократительную актин-миозин-АТФ-Мg + -реакцию. Показана также универсальная роль цАМФ как регулятора транспорта Са 2+ через биологические мембраны.
БК повышает внутриклеточную концентрацию Са 2+ и стимулирует Са 2+ АТФазу. БК стимулирует приток Са 2+ в клетку, сдвигая соотношение циклических нуклеотидов в сторону увеличения концентрации цГМФ. Зависимость спазмогенной реакции гладкомышечных органов на БК от притока Са 2+ из внеклеточного пространства внутрь клетки подтверждена рядом авторов. Не решен окончательно вопрос о том, участвует ли локализованный внутриклеточно Са 2+ в реакции гладкомышечных органов на БК.
Фармакологические препараты, воздействующие на активность ККС
По характеру конечного фармакологического эффекта вещества, влияющие на активность ККС, условно можно подразделить на кини-нопозитивные (увеличивающие образование кининов, усиливающие их биологические эффекты и тормозящие инактивацию) и кининоне-гативные (уменьшающие кининогенез, ускоряющие разрушение кининов, блокирующие их эффекты в тканях) (Г.Я. Шварц, 1979).
Среди кининопозитивных веществ - препараты протеолитиче-ских ферменгов и прежде всего основного кининообразующего фермента калликреина. Содержащие калликреин препараты представляют собой различной степени очистки экстракты из поджелудочной железы крупного рогатого скота или свиней и выпускаются под названиями падутин, депо-падутин, депо-калликреин, андекалин, долминал Д и др. Они применяются для лечения заболеваний, сопровождающихся спазмами периферических сосудов (эндартериит, болезнь Рейно и др.), а также в комплексной терапии начальных стадий гипертонической болезни. Препараты калликреинов нашли применение при лечении заболеваний, связанных с нарушением образования и подвижности сперматозоидов, мужском бесплодии, азоспермии и др. Механизм активации сперматогенеза и усиления подвижности сперматозоидов под втия-нием терапии препаратами калликреина неясен.
Активацию кининогенеза вызывает и ряд сульфатированных полисахаридов - сульфат целлюлозы, декстран-сульфат и каррагенин. Действие этих веществ связано с активированием фактора Хагемана (XII фактора свертывания крови), являющегося пусковым звеном реакции кининогенеза в плазме крови. При введении в кровяное русло сульфатированные полисахариды вызывают быстрое образование кининов из кининогена и, в зависимости от использованной дозы, снижение системного АД, связанное с появлением в крови свободных кининов. Сульфатированные полисахариды не применяют в медицине, однако они широко используются в фармакологических экспериментах в качестве своеобразного "инструмента" для изучения различных аспектов метаболизма кининов и воспроизведения моделей активации кининогенеза, воспаления и некоторых других патологических состояний.
Другой группой веществ, вызывающих увеличение образования и активности калликреинов, являются минералокортикоиды. У людей, собак и крыс повышение выделения калликреинов почками вызывают альдостерон и дезоксикортикостерон. Данный эффект развивается постепенно и достигает максимума на третьи сутки после введения указанных препаратов.
Кининопозитивными свойствами обладают вещества, тормозящие инактивацию кининов и увеличивающие их концентрацию в крови или тканях, что ведет к усилению и пролонгированию биологических эффектов кининов.
Уже в 60-х годах были обнаружены вещества природного и неприродного происхождения, усиливающие и пролонгирующие действие кининов за счет ингибирования кининоразрушающих ферментов - кининаз. Среди них тиоловые соединения - цистеин, 2,3-димер-каптопропанол (BAL), унитиол, D-пеницилламин, 2-меркаптоэтанол, Р-меркаптоэтаноламин, диэтилдитиокарбамат, глютатион, дисульфи-рам и др. Среди нетиоловых ингибиторов кининаз - этилендиамин-тетрауксусная кислота (ЭДТА), 8-оксихинолин, 1,10-фенантролин, некоторые производные фенотиазина и др. Как тиоловые, так и нетиоловые ингибиторы кининаз практического медицинского применения не нашли. Их используют (8-оксихинолин, 1,10-фенантролин) в биохимических экспериментах для ингибирования находящихся в пробах кининаз и предупреждения инактивации кининов.
Важное значение для работ по практическому использованию ингибиторов кининаз имели выделение, очистка и изучение свойств так называемых "брадикинин-потенцирующих пептидов", выделенных из ядов змей Bothrops jararaca Ankistrodon halys bromhoftii.
Среди соединений, действующих на кининазы, по активности и специфичности выделяется 0-3-меркапто-2-метил-пропаноил-Ь-про-лин (шифр SQ 14,225), получивший название каптоприл (синонимы капотен, лопирин). Каптоприл обладает характерными для ингибиторов кининаз свойствами: усиливает и пролонгирует депрессорный и другие биологические эффекты БК (рис. 20) при одновременном уменьшении действия ангиотензина I. Каптоприл при энтеральном и парентеральном введении понижает АД у животных с разными моделями экспериментальной гипертензии. Высокая активность каптопри-ла была подтверждена при его клиническом изучении: в дозах 150-450 мг в сутки он оказывает четкий антигипертензивный эффект.
Специфических ингибиторов калликреинов до настоящего времени не обнаружено, хотя исследования в этой области привели к получению ряда производных бензамидина, обладающих сравнительно высокой активностью. Неспецифическими ингибиторами калликреинов являются различные по химическому строению соединения: ди-изопропиофторфосфат (ДФФ), Е-аминокапроновая кислота, прота-минсульфат, гексадиметрин бромид, некоторые нестероидные противовоспалительные препараты (НПВП) (Г.Я. Шварц и соавт., 1984 и др.).
Как правило, степень торможения активности калликреина НПВП коррелирует с силой их противовоспалительного действия и наиболее выражена у таких эффективных современных ЛС этой группы, как ортофен, напроксен и индометацин (рис. 21). Активность калликреинов тормозят также вещества растительного и животного происхождения: ингибитор из бобов сои, ингибиторы из клубней картофеля, поливалентные ингибиторы из различных органов крупного рогатого скота. Несмотря на некоторые различия в специфичности и силе действия, указанные ингибиторы уменьшают эстеразную и кинино-геназную активность большинства тканевых и плазменных калликреинов.
Одним из наиболее широко применяемых в медицине ингибиторов калликреинов является так называемый ингибитор Кунитца, входящий в состав препаратов трасилол, зимофен, контрикал, апронитин и др., получаемых из поджелудочной и околоушных желез, а также легких быка. Ингибитор Кунитца является одним из наиболее активных ингибиторов протеиназ, он связывается с молекулами чувствительных к нему ферментов в стехиометрических соотношениях с константой ассоциации 10 13 М -1 (для трипсина).
ЛС, содержащие поливалентный ингибитор протеиназ, широко применяют для лечения острого панкреатита, панкреонекроза, а также других заболеваний, сопровождающихся аутолизом тканей. Трасилол и контрикал успешно используют в комплексной терапии острого инфаркта миокарда. Образуя биологически малоактивные комплексы с калликреинами и другими протеиназами, предупреждая кининообра-зующее действие этих ферментов, ингибиторы являются эффективными средствами патогенетической терапии заболеваний, сопровождающихся активацией кининогенеза. Недостатками всех комплексных препаратов поливалентного ингибитора протеаз из органов крупного рогатого скота является небольшая продолжительность действия, связанная с быстрым выведением препаратов из организма, и неэффективность при энтеральном пути введения.
Важной группой кининонегативных препаратов являются антагонисты кининов. Эта группа веществ, весьма разнородная как в химическом, так и фармакологическом отношении, давно привлекает внимание специалистов, т. к. антагонисты различных биологически активных веществ (адреналина и норадреналина, гистамина, серотонина, АХ и др.) широко используются в качестве ЛС.
Антибрадикининовыми свойствами (анти-БК) обладают некоторые НПВП. Они уменьшают спазмогенный эффект кининов, вызываемое ими повышение проницаемости микрососудов, но не изменяют их депрессорного действия. Большинство НПВП предупреждают развитие БК-бронхоспазма у морских свинок. В этом отношении наиболее активны ацетилсалициловая кислота и ее производные, мефена-миновая и флюфенамовая кислоты, индометацин.
Анти-БК активность обнаружена у ряда ЛС, различных по характеру фармакологического действия и по химическому строению (табл. 17). Так, этим видом активности обладают некоторые производные фенотиазина, тиоксантена, циклогептатриенилидена. Однако попытки выявить связь между строением и анти-БК активностью указанных химических соединениях не дали положительных результатов.
Среди производных фенотиазина, проявляющих неконкурентный антагонизм к миотропным эффектам БК, наиболее активны аминазин и фенерган. Еще более активны в этом отношении препараты инсидон (производное иминостильбена) и антигистаминный и антисеротони-новый препарат ципрогептадин.
Среди производных тиоксантена анти-БК активность обнаружена у тремарила и некоторых его производных. Подтверждением наличия у трициклических соединений анти-БК активности стало обнаружение этих свойств у антидепрессивных препаратов амитриптилина и имип-рамина. Неспецифический антагонизм к некоторым эффектам БК проявляют антигистаминные препараты - димедрол, пипольфен, суп-растин и др. (Г.Я. Шварц, 1979), антагонист Са 2+ - циннаризин (стуге-рон), являющийся производным циннамил-пиперазина, венотонизи-рующее средство гливенол (производное глюкофуранозида), р-адрено-миметические препараты изадрин, орципреналин и триметаквинол (Г.Я. Шварц, 1981) и др. Наличие анти-БК свойств отмечено у антиок-сидантов оксианизола и его бутилового аналога, стрептомицина и витамина Кз.
Среди производных пиридина анти-БК свойства наиболее выражены у пармидина (пиридинолкарбамата). Этот препарат является избирательным, конкурентным, специфическим и обратимым антагонистом БК и других кининов. Он уменьшает действие БК на изолированные органы разных видов животных, содержащие кининовые рецепторы типов Bi и Вг- Благодаря наличию анти-БК свойств, парми-дин оказывает противовоспалительное и аналгезирующее действие, нормализует нарушенную проницаемость сосудов, вызывает гипокоа-гулирующий и антиатеросклеротический эффекты. Пармидин (таблетки по 0,25 г) эффективен при лечении атеросклеротических поражений периферических сосудов (эндартериит, перемежающаяся хромота, болезнь Бюргера и др.), а также сосудов сердца и мозга. Пармидин оказывает лечебный эффект и при атеросклеротических и диабетических поражениях микрососудов почек и глаз.
Ренин-ангиотензиновая система
Регуляция кровяного давления в организме человека осуществляется комплексом сложно взаимодействующих нервных и гуморальных влияний на тонус сосудов и деятельность сердца. Управление прессорными и вазопрессорными реакциями связано с деятельностью бульбарных сосудодвигательных центров, контролируемой гипоталамическими, лимбикоретикулярными структурами и корой мозга, и реализуется через изменение активности парасимпатических и симпатических нервов, регулирующих тонус сосудов, деятельность сердца, почек и эндокринных желез, гормоны которых участвуют в регуляции кровяного давления. Среди гормонов наибольшее значение имеют АКТГ и вазопрессин гипофиза, адреналин и гормоны коры надпочечников, а также гормоны щитовидной и половых желез.
Гуморальное звено регуляции кровяного давления человека представлено ренин-ангиотензин-альдостероновой системой, активность которой зависит от режима кровоснабжения и функции почек, простагландинами и рядом иных вазоактивных субстратов различного происхождения.
Натриевый баланс организма также подвержен гормональному влиянию через слаженную работу ренин-ангиотензин-альдостероновой системы, основная физиологическая задача которых заключается в поддержании водно-солевого гомеостаза и обмена натрия на оптимальном уровне как ключевого звена этого процесса, главным образом за счет обеспечения эффективной избирательной реабсорбции натрия в почках.
Ренин-ангиотензиновая система представляет собой систему ферментов и гормонов, регулирующих артериальное давление, электролитный и водный баланс у млекопитающих. См схему. Ангиотензин II (Анг II), один из важнейших компонентов РАС, образуется из белкового предшественника ангиотензиногена в результате последовательного действия нескольких протеолитических ферментов. Классический путь образования Анг II включает реакцию, катализируемую ангиотензин-превращающим ферментом (АПФ) . Однако у млекопитающих существуют альтернативные пути образования Анг II.
Описаны различные Анг-II -генерирующие ферменты (тонин, калликреин, химаза, катепсин G и др.) и их свойства.
Ангиотензин II представляет собой октапептид который обладает свойствами вазоконстриктора и способствует секреции альдостерона. Он образуется in vivo из белка-предшественника ангиотензиногена, который циркулирует в плазме крови.
Ангиотензины принимают участие в патогенезе гипертоний, заболеваний сосудов, гипертрофии сердца, сердечной недостаточности и поражения почек при диабете [ Goodfriend, ea 1996 , Campbell, ea 1987 ].
Анг II стимулирует разнообразные физиологические ответы, обеспечивая регуляцию артериального давления крови, электролитного и водного баланса; он является наиболее известным и сильнодействующим гипертензивным веществом [ Goodfriend, ea 1996 , Reilly, ea 1982 , Hollenberg, ea 1998 , Campbell, ea 1987 ].
Ренин, ангиотензиноген, Анг I, АПФ и Анг II образуют ренин- ангиотензиновую систему (РАС) крови и тканей.
В настоящее время признано существование двух, функционирующих независимо друг от друга систем РАС:
Ренин-ангиотензиновая система (РАС) циркуляторная
В циркуляторной РАС Ангиотензин II образуется из ангиотензиногена под действием ренина и АПФ. Однако продуцирование Анг II может осуществляться за счет других ферментативных превращений независимо от ренина и АПФ. В настоящее время описано несколько ферментов, способных генерировать Анг II из ангиотензиногена и/или Анг I [ Reilly, ea 1982 , Hollenberg, ea 1998 , Unger, ea 1990 , Akasu, ea 1998 Dzau, ea 1984 , Kifor, ea 1987 , Akasu, ea 1998 , Dzau, ea 1989 , Dzau, ea 1988 , Tang, ea 1989 , Wintroub, ea 1986 ].
Некоторые из этих ферментов способны превращать проренин в ренин [ Campbell, ea 1987 , Dzau, ea 1989 ] (рис. 1). Таким образом, образование Анг II может происходить под действием различных ферментов: АПФ, химазы, тонина и т.д.
РАС тканевая (местная) [ Campbell, ea 1987 , Unger, ea 1990 , Dzau, ea 1984 , Kifor, ea 1987 , 14 , 15 , 16 ].
Тканевые РАС (в которых активность АПФ ответственна только за 10-20% превращения Анг I в Анг II а за остальное ответственны ангиотензин II превращающие ферменты типа сериновых протеиназ) являются системами исключительно длительного регулирования, обеспечивающими тоническое и/или модулирующее действие на структуру и функцию органов и тканей [ Dzau, ea 1988 , Dzau, ea 1993 , Скворцов ea 1998 ].
помимо классического пути образования Анг II под действием ренина и АПФ, существует еще альтернативный путь, при котором генерирование Анг II из ангиотензиногена и/или Анг I происходит под действием сериновых протеиназ [ Campbell, ea 1987 , Dzau, ea 1989 , Boucher, ea 1977 , Klickstein, ea 1982 , Tonnesen, ea 1982 ] (рис. 1). Накоплены многочисленные доказательства того, что в сердце, легких, крупных артериях и почках помимо АПФ содержатся сериновые Анг II-образующие ферменты [ Hollenberg, ea 1998 , Campbell, ea 1987 , Akasu, ea 1998 ].
По номенклатуре, предложенной Аракавой [ Arakawa, ea 1996 ], Анг II-образующие сериновые протеиназы делятся на две группы: апротинин-чувствительные или калликреиноподобные (трипсин и калликреин) и химостатинчувствительные или химазного типа (химаза) (см. рис. 2). Классификация Аракавы не представляется исчерпывающей, так как такой Анг II-генерирующий фермент, как катепсин G, ингибируется и апротинином, и химостатином. Л.А. Беловой с сотр предложена более полная схема деления сериновых Анг II-ге-нерирующих ферментов, так как к их числу (помимо упоминаемых Аракавой относятся тонин, катепсин G и др. Предлагаемая нами классификация Анг II-образующих ферментов - трипсиноподобные протеиназы (трипсин, калликреин, тонин и т.д.) и химотрипсиноподобные протеиназы (катепсин G и химазы) - учитывает природу активного центра фермента.
(- 1. Калликреины (EC З.4.21.34 , EC З.4.21.35 ,) широко распространены в тканях и биологических жидкостях организма, включая кровь [ Антонов ea 1991 , Чернух ea 1980 , Handbook ea 1998 ]. По ряду свойств калликреины напоминают трипсин [ Антонов ea 1991 , Чернух ea 1980 ].
Калликреин плазмы крови (EC 3.4.21.34B) (молекулярная масса 97 кДа) вырабатывается в печени в виде неактивного предшественника - прекалликреина [ Антонов ea 1991 , Чернух ea 1980 ].
Тканевые калликреины (EC 3.4.21.35) содержатся в секретах многих железистых органов в активной форме (поджелудочный сок, слюна, пот, слезы, моча). Молекулярные массы калликреинов мочи, поджелудочной и подчелюстной желез близки: 32, 33 и 36 кДа [ Чернух ea 1980 ]. Калликреины плазмы и тканей отличаются друг от друга по иммунологическим и физ-химическим свойствам [ Чернух ea 1980 , Handbook ea 1998 ].
Под действием калликреина плазмы на кининогены образуется брадикинин, а продуктом действия калликреина поджелудочной железы и калликреинов других желез является декапептид каллидин, который под действием аминопептидазы превращается в крови в брадикинин.
2. - Способность тканевого активатора плазминогена (тАП) , превращать ангио-тензиноген в Анг II может иметь физиологическое значение [ Tang, ea 1989 ]. Дзау и соавт. [ Dzau, ea 1989 , Tang, ea 1989 ] показали, что тАП может образовывать Анг II из Анг-(1-14) и очищенного ангиотензиногена человека. тАП как Анг II-генерирующий фермент может действовать внутри клетки или в местах повреждения сосудов и некрозов, где рН 4-6,5. In vivo освобождение тАП в кровоток может происходить как вследствие механического повреждения тканей, так и в результате повреждений, вызванных гипоксией, связанной с нарушением нормального кровоснабжения ткани в результате тромбообразования [ Антонов ea 1991 ]. Таким образом, тАП в качестве Анг II-образующего фермента может местно регулировать тонус сосудов и вызывать спазм сосудов в местах их повреждения
3. - Тонин принадлежит к тому же семейству сериновых протеиназ, что и тканевые калликреины и гамма-субъединица фактора роста нервной ткани [ Reilly, ea 1982 , Boucher, ea 1977 , Handbook ea 1998 , Thibault, ea 1981 ]. Тонин генерирует Анг II из ангиотензиногена, Анг-(1-14) и Анг I, но в отличие от АПФ не инактивирует брадикинин [ Boucher, ea 1977 , Klickstein, ea 1982 , Thibault, ea 1981 ]. Тонин обладает трипсиноподобной активностью, так как гидролизует большинство субстратов, расщепляемых трипсином. Тонин проявляет эстеразную активность в большей степени, чем амидолитическую. рН-Оптимум для реакции гидролиза Tos-Arg-OMe равен 8,5, для Bz-Arg-OEt - 9,0, для Bz-Arg-OMe -9,0-9,5 и для Bz-Arg-pNA - больше 10,0. Среди указанных субстратов лучшим является Bz-Arg-OEt (на основании величины kcat) [ Thibault, ea 1981 ]. Субстраты, содержащие остатки тирозина или фенилаланина, которые легко гидролизуются химотрипсином, практически не гидролизуются тонином [ Handbook ea 1998 , Thibault, ea 1981 , Tanaka, ea 1985 ]. Однако, хотя тонин проявляет гидролитическую активность по отношению к синтетическим субстратам трипсина и не гидролизует синтетические субстраты химотрипсина, он проявляет по отношению к Анг I только химотрипсиноподобную активность, расщепляя связь Phe-His в Анг I и (des-Aspl)-Aнг I [ Boucher, ea 1977 , Klickstein, ea 1982 , Thibault, ea 1981 ]. При использовании в качестве субстрата Анг I или Анг-(1-14) рН-оптимум действия тонина составляет 6,8 [ Boucher, ea 1977 ]. Тонин ингибируется ОПИТ и СБТИ. Тем не менее ингибиторы сериновых протеиназ ДИФФ и ФМСФ, которые почти полностью ингибируют трипсин и химотрипсин при молярном соотношении ингибитор: фермент больше 100, ингибируют тонин лишь на 40% даже при молярном соотношении свыше- 10 000 [ Thibault, ea 1981 ]. Тонин не ингибируется пепстатином, ЭДТА и каптоприлом [ Boucher, ea 1977 , Thibault, ea 1981 ]. По мнению Тибо и Генеста [ Thibault, ea 1981 ] тонин идентичен саливаину (молекулярная масса 30 кДа, р1 -6,0), щелочной протеиназе из подчелюстной железы мышей, которая при рН 9,0-9,3 проявляет максимальную активность как по отношению к белковым, так и по отношению к синтетическим субстратам (BzArgOEt и BzArgOMe) [ Антонов ea 1991 , Riekkinen, ea 1967 ]. Этот фермент ингибируется ДИФФ и ОПИТ, и не ингибируется ЛБТИ или овомукоидом [ Антонов ea 1991 , Riekkinen, ea 1967 ]. Ряд авторов считает, что калликреиноподобные Анг II-образующие ферменты (в том числе тонин) играют важную роль в регуляции РАС мозга [ Uddin, ea 1995 , Lippoldt, ea 1995).
Аракава и соавт. [ Arakawa, ea 1980 , Sasaguri, ea 1997 ] предложили термин " кинин-тензиновая система " для тех сериновых протеиназ, которые генерируют Анг II из ангиотензиногена и кинины из кининогена (трипсин, тонин, тканевые калликреины). Таким образом, одна ферментная система проявляет две противоположные биологические активности - вазо- депрессорную и вазопрессорную - и направление реакции зависит от рН среды. При рН 8,0-9,0 эти ферменты действуют как кининогеназы, генерируя кинины, а при рН 4,0-6,5 - как Анг II-генерирующие ферменты [ Maruta, ea 1983 , Arakawa, ea 1980 , Sasaguri, ea 1997 ].
4. - Трипсин (EC 3.4.21.20) - панкреатическая сериновая протеиназа, которая секретируется в кишечник и расщепляет белки пищи. Трипсин катализирует гидролиз пептидных связей X-Y белков, содержащих в положении Х основные аминокислоты, такие как лизин или аргинин. Трипсин имеет рН-оптимум действия 7,0-8,0 в зависимости от используемого субстрата. Для активации и стабилизации трипсина необходимо наличие ионов Са2+ в реакционной среде [ Антонов ea 1991 , Schwartz, ea 1970 ]. In vitro трипсин может генерировать из кининогенов брадикинин, являясь таким образом кинин-образующим ферментом. Известно также, что трипсин может активировать проренин и генерировать Анг II из ангиотензиногена)
Ренин-ангиотензиновая система наиболее активна при тяжелой острой сердечной недостаточности, в меньшей степени - при хронической компенсированной сердечной недостаточности.
Блокаторы ангиотензиновых рецепторов и ингибиторы АПФ препятствуют эффектам активации ренин-ангиотензиновой системы.
Ренин-ангиотензиновая система: активация и отеки
При дефиците натрия в организме и уменьшении кровоснабжения почек в кровь выделяется образующийся в юкстагломерулярном аппарате ренин. Являясь протеиназой ренин действует на альфа-2 глобулин крови (гипертензиноген), отщепляя декапептид - ангиотензин I. Под влиянием пептидазы от молекулы физиологически неактивного ангиотензина I отщепляются две аминокислоты (гистидин и лейцин) и формируется октапептид - ангиотензин II. Большая част