Реакции, подтверждающие взаимосвязь различных классов неорганических веществ (2) - Документ. Пособие-репетитор по химии Раствор иодида калия и хлорной водой
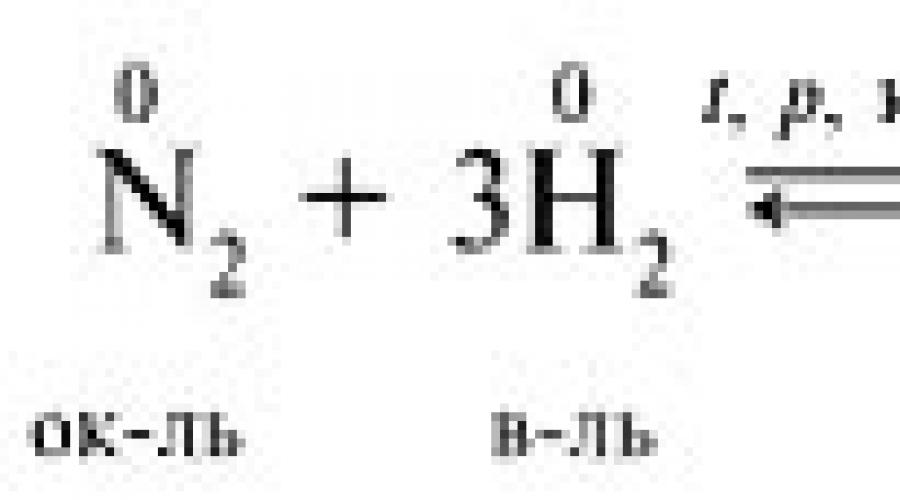
Читайте также
Решение:
2Cl2 + 2Н2О = 4HCl + О2
mp-pa = m(Н2О) + m(Cl2) − m(О2) ;
Δm = m(Cl2) − m(О2) ;
Примем n(Cl2) за х , тогда n(О2) = 0,5х;
Составим алгебраическое уравнение на основе приведённого равенства и найдём х :
Δm = х · M(Cl2) − 0,5х · М(О2) = х(71 − 16) = 55х;
х = 0,04 моль;
V(Cl2) = n(Cl2) · Vm = 0,004 · 22,4 = 0,896 л.
Ответ: 0,896 л.
10. Вычислите область допустимых значений объёма хлора (н. у.), который необходим для полного хлорирования 10,0 г смеси железа и меди.
Решение:
Поскольку в условии не сказано каково соотношение металлов в смеси, то остаётся предположить, что областью допустимых значений объёма хлора в данном случае будет диапазон между его объёмами, требуемыми для хлорирования 10 г каждого металла в отдельности. И решение задачи сводится к последовательному нахождению этих объёмов.
2Fe + 3Cl2 = 2FeCl3
Cu + Cl′2 = CuCl2
n(Cl2) = 1,5n(Fe) = 1,5 · 10/56 = 0,26 моль;
V(Cl2) = n(Cl2) · Vm = 0,26 · 22,4 = 5,99 ≈ 6 л;
n(Cl′2) = n(Cu) = 10/63,5 = 0,16 моль;
V(Cl′2) = 22,4 · 0,16 = 3,5 л.
Ответ: 3,5 ≤ V(Cl2) ≤ 6л.
11. Вычислите массу йода, которая образуется при обработке избытком подкисленного раствора перманганата калия смеси дигидрата йодида натрия, йодида калия и йодида магния, в которой массовые доли всех солей равны, а суммарное количество всех веществ составляет 50,0 ммоль.
Решение:
Запишем уравнения реакций, протекающих в растворе, и составим общие полуреакции, на основе которых расставим коэффициенты:
10NaI·2H2O + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 5Na2SO4 + K2SO4 + 28H2O
10KI + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
5MgI2 + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 5MgSO4 + K2SO4 + 8H2O
MnO4¯+ 8H+ + 5ē = Mn2+ + 4H2O 2
2I¯− 2 ē = I2 5
2 MnO4¯+ 16H+ + 10 I¯= 2 Mn2+ + 5I2 + 8H2O
Из равенства массовых долей компонентов смеси следует, что равны и их массы. Приняв их за х составим алгебраическое уравнение на основе равенства:
n1 + n2 + n3 = 50,0 ммоль
m1/М(NaI·2H2O) + m2/М(KI) + m3/М(MgI2) = 50,0 ммоль
m1 = m2 = m3 = х
х/186 + х/166 + х/278 = 50·10-3моль
m (I2)1 = 5М(I2) · m(NaI·2H2O)/10М(NaI·2H2O) = (5· 254 · 3,33)/10 · 186 = 2,27 г;
m (I2)2 = 5М(I2) · m(KI)/10М(KI) = (5· 254 · 3,33)/10 · 166 = 2,55 г;
m (I2)3 = 5М(I2) · m(MgI2)/10М(MgI2) = (5· 254 · 3,33)/10 · 278 = 3,04 г.
Итого: 7,86 г.
Ответ: 7,86 г.
12. При пропускании через 200 г 5,00%-го раствора пероксида водорода хлора масса раствора увеличилась на 3,9 г. Вычислите массовые доли веществ в получившемся растворе.
Решение:
Н2О2 + Cl2 = О2 + 2НCl
1. Найдём исходное количество Н2О2 в растворе:
n1(Н2О2) = m/М(Н2О2) = mР-РА· ω/ М(Н2О2) = 200 · 0,05/34 =
2. Примем количество поглощенного хлора в растворе за х , тогда nО2 = х, а увеличение массы раствора обусловлено разницей масс поглощенного хлора и выделившегося кислорода:
m(Cl 2) − m(О 2) = Δ m или х·М(Cl 2) − х·М(О2) = Δ m;
71х − 32х = 3,9; х = 0,1 моль.
3. Вычислим количества веществ оставшихся в растворе:
n2(Н2О2)ОКИСЛЕННОЕ = n(Cl 2) = 0,1 моль;
n(Н2О2)ОСТАВШЕЕСЯ В РАСТВОРЕ = n1 − n2 = 0,294 − 0,1 = 0,194 моль;
n(НCl) = 2n(Cl 2) = 0,2 моль.
4. Находим массовые доли веществ в образовавшемся растворе:
ω(Н2О2) = n(Н2О2) · М(Н2О2)/ mР-РА = 0,194 · 34/203,9 · 100% = 3,23%;
ω(НCl) = n(НCl) · М(НCl)/ mР-РА = 0,2 · 36,5/203,9 · 100% = 3,58%.
Ответ: ω(Н2О2) = 3,23%;
ω(НCl) = 3,58%.
13. Тетрагидрат бромида марганца (II) массой 4,31 г растворили в достаточном объёме воды. Через полученный раствор пропускали хлор до тех пор, пока молярные концентрации обеих солей не сравнялись. Вычислите, какой объём хлора (н. у.) был пропущен.
Решение:
Mn Br2 · 4H2O + Cl2 = MnCl2 + Br2 + 4H2O
1. Найдём исходное количество тетрагидрата бромида марганца (II) в растворе:
n(Mn Br2 · 4H2O)ИСХ. = m/M = 4,31/287 = 1,5·10−2моль.
2. Равенство молярных концентраций обеих солей наступит, когда половина исходного количества Mn Br2 · 4H2O будет израсходована. Т. о. количество требуемого хлора может быть найдено из уравнения реакции:
n(Cl2) = n(MnCl2) = 0,5 n(Mn Br2 · 4H2O)ИСХ. = 7,5·10−3моль.
V(Cl2) = n·Vm = 7,5·10−3·22,4 = 0,168 л.
Ответ: 0,168 л.
14. Через 150 мл раствора бромида бария с молярной концентрацией соли 0,05 моль/л пропускали хлор, пока массовые доли обеих солей не сравнялись. Вычислите, какой объём хлора (200С, 95 кПа) был пропущен.
Решение:
BaBr2 + Cl2 = BaCl2 + Br2
1. Из равенства массовых долей образующихся солей следует равенство их масс.
m(BaCl2) = m(BaBr2) или n(BaCl2)·М(BaCl2) = n′(BaBr2)·М(BaBr2).
2. Примем n(BaCl2) за х моль, а n′(BaBr2), оставшийся в растворе, за СМ ·V − х = 0,15·0,05− х = 7,5·10−3− х и составим алгебраическое уравнение:
208х = (7,5·10−3− х)·297;
2,2275 = 297х +208х;
3. Найдём количество хлора и его объём:
n(Cl2) = n(BaCl2) = 0,0044 моль;
V(Cl2) = nRT/P = (0,0044·8,314·293)/95 = 0,113 л.
Ответ: 113 мл.
15. Смесь бромида и фторида калия общей массой 100 г растворили в воде; через полученный раствор пропустили избыток хлора. Масса остатка, после выпаривания и прокаливания равна 80,0 г. Вычислить массовые доли веществ в полученной смеси.
Решение:
1. После прокаливания продуктов реакции остаток состоит из фторида и хлорида калия:
2КBr + Cl2 = 2КCl + Br2
2. Примем количества KF и КBr за х и у соответственно, тогда
n(КCl) = n(КBr) = у моль.
Составим систему уравнений на основе равенств:
m(KF) + m(КBr) = 100
m(KF) + m(КCl) = 80
n(KF)·М(KF) + n(КBr)·М(КBr) = 100
n(KF)·М(KF) + n(КCl)·М(КCl) = 80
58х + 119у = 100 58х = 100 – 119у
58 х + 74,5у = 80 100 – 119у + 74,5у = 80
44,5у = 20; у = 0,45; х = 0,8.
3. Найдём массы веществ в остатке и их массовые доли:
m(KF) = 58·0,8 = 46,5 г.
m(КCl) = 74,5·0,45 = 33,5 г.
ω(KF) = 46,5/80·100% = 58,1%;
ω(КCl) = 33,5/80·100% = 41,9%.
Ответ: ω(KF) = 58,1%;
ω(КCl) = 41,9%.
16. Смесь бромида и йодида натрия обработали избытком хлорной воды, полученный раствор выпарили и прокалили. Масса сухого остатка оказалась в 2,363 раза меньше массы исходной смеси. Во сколько раз масса осадка, полученного после обработки такой же смеси избытком нитрата серебра, будет больше массы исходной смеси?
Решение:
2NaBr + HClO +HCl = 2NaCl + Br2 + H2O
2NaI + HClO +HCl = 2NaCl + I2 + H2O
1. Примем массу исходной смеси за 100 г, а количества образующих её солей NaBr и NaI, за х и у соответственно. Тогда на основании отношения(m(NaBr) + m(NaI))/ m(NaCl) = 2,363 составим систему уравнений:
103х + 150у = 100
2,363·58,5(х+у) = 100
х = 0,54 моль; у = 0,18 моль.
2. Запишем вторую группу реакций:
NaBr + AgNO3 = AgBr↓ + NaNO3
NaI + AgNO3 = AgI↓ + NaNO3
Тогда для определения отношения масс образовавшегося осадка и исходной смеси веществ, (принятую за 100 г), остаётся найти количества и массы AgBr и AgI, которые равны n(NaBr) и n(NaI) соответственно, т. е. 0,18 и 0,54 моль.
3. Находим отношение масс:
(m(AgBr) + m(AgI))/(m(NaBr) + m(NaI)) =
(М(AgBr)·х + М(AgI)·у)/100 =
(188·0,18 + 235·0,54)/100 =
(126,9 + 34,67)/100 = 1,62.
Ответ: 1,62 раза.
17. Смесь йодида магния и йодида цинка обработали избытком бромной воды, полученный раствор выпарили и прокалили при 200 – 3000С. Масса сухого остатка оказалась в 1,445 раза меньше массы исходной смеси. Во сколько раз масса осадка, полученного после обработки такой же смеси избытком карбоната натрия, будет меньше массы исходной смеси?
Решение:
1. Запишем обе группы реакций, обозначив массы исходной смеси веществ и образующихся продуктов как m1 , m2 , m3.
(MgI2 + ZnI2)+ 2Br2 = (MgBr2 + ZnBr2)+ 2I2
(MgI2 + ZnI2)+ 2 Na2CO3 = (MgCO3 + ZnCO3)↓ + 4NaI
m1/ m2 = 1,445; m1/ m3 = ?
2. Примем количества солей в исходной смеси за х (MgI2) и у (ZnI2), тогда количества продуктов всех реакций можно выразить как
n(MgI2) = n(MgBr2) = n(MgCO3) = х моль;
n(ZnI2) = n(ZnBr2) = n(ZnCO3) = у моль.
Задания С 2 (2013г)
Реакции, подтверждающие взаимосвязь различных классов неорганических веществ
Оксид меди(II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том и в другом случае наблюдали образование осадка. Напишите уравнения четырех описанных реакций.
Нитрат меди прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекало с выделением бурого газа. Напишите уравнения четырех описанных реакций.
Железо сожгли в атмосфере хлора. Полученное вещество обработали избытком раствора гидроксида натрия. Образовался бурый осадок, который отфильтровали и прокалили. Остаток после прокаливания растворили в иодоводородной кислоте. Напишите уравнения четырех описанных реакций.
Порошок металлического алюминия смешали с твердым иодом и добавили несколько капель воды. К полученной соли добавили раствор гидроксида натрия до выпадения осадка. Образовавшийся осадок растворили в соляной кислоте. При последующем добавлении раствора карбоната натрия вновь наблюдали выпадение осадка. Напишите уравнения четырех описанных реакций.
В результате неполного сгорания угля получили газ, в токе которого нагрели оксид железа(III). Полученное вещество растворили в горячей концентрированной серной кислоте. Образовавшийся раствор соли подвергли электролизу. Напишите уравнения четырех описанных реакций.
Некоторое количество сульфида цинка разделили на две части. Одну из них обработали азотной кислотой, а другую подвергли обжигу на воздухе. При взаимодействии выделившихся газов образовалось простое вещество. Это вещество нагрели с концентрированной азотной кислотой, причем выделился бурый газ. Напишите уравнения четырех описанных реакций.
Серу сплавили с железом. Продукт реакции растворили в воде. Выделившийся при этом газ сожгли в избытке кислорода. Продукты горения поглотили водным раствором сульфата железа(III). Напишите уравнения четырех описанных реакций.
Железо сожгли в хлоре. Полученную соль добавили к раствору карбоната натрия, при этом выпал бурый осадок. Этот осадок отфильтровали и прокалили. Полученное вещество растворили в иодоводородной кислоте. Напишите уравнения четырех описанных реакций.
Раствор иодида калия обработали избытком хлорной воды, при этом наблюдали сначала образование осадка, а затем – его полное растворение. Образовавшуюся при этом иодосодержащую кислоту выделили из раствора, высушили и осторожно нагрели. Полученный оксид прореагировал с угарным газом. Запишите уравнения описанных реакций.
Порошок сульфида хрома(III) растворили в серной кислоте. При этом выделился газ и образовался окрашенный раствор. К полученному раствору добавили избыток раствора аммиака, а газ пропустили через нитрата свинца. Полученный при этом черный осадок побелел после обработки его пероксидом водорода. Запишите уравнения описанных реакций.
Порошок алюминия нагрели с порошком серы, полученное вещество обработали водой. Выделившийся при этом осадок обработали избытком концентрированного раствора гидроксида калия до его полного растворения. К полученному раствору добавили раствор хлорида алюминия и вновь наблюдали образование белого осадка. Запишите уравнения описанных реакций.
Нитрат калия нагрели с порошкообразным свинцом до прекращения реакции. Смесь продуктов обработали водой, а затем полученный раствор профильтровали. Фильтрат подкислили серной кислотой и обработали иодидом калия. Выделившееся простое вещество нагрели с концентрированной азотной кислотой. В атмосфере образовавшегося при этом бурого газа сожгли красный фосфор. Запишите уравнения описанных реакций.
Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Запишите уравнения описанных реакций.
Магний растворили в разбавленной азотной кислоте, причем выделение газа не наблюдалось. Полученный раствор обработали избытком раствора гидроксида калия при нагревании. Выделившийся при этом газ сожгли в кислороде. Запишите уравнения описанных реакций.
Смесь порошков нитрита калия и хлорида аммония растворили в воде и раствор осторожно нагрели. Выделившийся газ прореагировал с магнием. Продукт реакции внесли в избыток раствора соляной кислоты, при этом выделение газа не наблюдалось. Полученную магниевую соль в растворе обработали карбонатом натрия. Запишите уравнения описанных реакций.
Оксид алюминия сплавили с гидроксидом натрия. Продукт реакции внесли в раствор хлорида аммония. Выделившийся газ с резким запахом поглощен серной кислотой. Образовавшуюся при этом среднюю соль прокалили. Запишите уравнения описанных реакций.
Хлор прореагировал с горячим раствором гидроксида калия. При охлаждении раствора выпали кристаллы бертолетовой соли. Полученные кристаллы внесли в раствор соляной кислоты. Образовавшееся простое вещество прореагировало с металлическим железом. Продукт реакции нагрели с новой навеской железа. Запишите уравнения описанных реакций.
Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение. Полученный раствор обработали избытком соляной кислоты. Запишите уравнения описанных реакций.
Железо растворили в горячей концентрированной серной кислоте. Полученную соль обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом. Напишите уравнения четырёх описанных реакций.
|
1)CuO + CO=Cu+CO 2 2) Cu+Cl 2 =CuCl 2 3) 2CuCl 2 +2KI=2CuCl↓ +I 2 +2KCl 4) CuCl 2 +2AgNO 3 =2AgCl↓+Cu(NO 3) 2 |
1)Cu(NO 3) 2 2CuO+4NO 2 +O 2 2) CuO+2H 2 SO 4 =CuSO 4 +SO 2 +2H 2 O 3)CuSO 4 +H 2 O=Cu↓+H 2 SO 4 +O 2 (элект 4)Cu+4HNO 3 =Cu(NO 3) 2 +2NO 2 +2H 2 O |
1) 2Fe + 3Cl 2 = 2FeCl 3 2)FeCl 3 + 3NaOH = Fe(OH) 3 ↓+3NaCl 4)Fe 2 O 3 + 6HI = 2FeI 2 + I 2 + 3H 2 O |
|
1) 2Al+3I 2 = 2AlI 3 2) AlI 3 +3NaOH= Al(OH) 3 +3NaI 3)Al(OH) 3 +3HCl= AlCl 3 + 3H 2 O 4)2AlCl 3 +3Na 2 CO 3 +3H 2 O=2Al(OH) 3 +3CO 2 +6NaCl |
2) Fe 2 O 3 +CO=Fe+CO 2 3)2Fe+6H 2 SO 4 =Fe 2 (SO 4) 3 +3SO 2 +6H 2 O 4)Fe 2 (SO 4) 3 +4H 2 O=2Fe+H 2 +3H 2 SO 4 +O 2 (электролиз) |
1) ZnS+2HNO 3 =Zn(NO 3) 2 +H 2 S 2)2ZnS +3O 2 =2ZnO +2SO 2 3)2H 2 S+SO 2 =3S↓+2H 2 O 4)S+6HNO 3 =H 2 SO 4 +6NO 2 +2H 2 O |
|
2) FeS + 2H 2 O=Fe(OH) 2 +H 2 S 3)2H 2 S+3O 2 2SO 2 +2H 2 O 4)Fe 2 (SO 4) 3 +SO 2 +2H 2 O=2FeSO 4 + 2H 2 SO 4 |
1) 2Fe + 3Cl 2 = 2FeCl 3 2)2FeCl 3 +3Na 2 CO 3 =2Fe(OH) 3 +6NaCl+3CO 2 3) 2Fe(OH) 3 Fe 2 O 3 + 3H 2 O 4) Fe 2 O 3 + 6HI = 2FeI 2 + I 2 + 3H 2 O |
1)2KI+Cl 2 =2KCl+I 2 2)I 2 +5Cl 2 +6H 2 O=10HCl+2HIO 3 3)2HIO 3 I 2 O 5 + H 2 O 4) I 2 O 5 +5CO = I 2 +5CO 2 |
|
1)Cr 2 S 3 +3H 2 SO 4 =Cr 2 (SO 4) 3 +3H 2 S 2)Cr 2 (SO 4) 4 +6NH 3 +6H 2 O=2Cr(OH) 3 ↓+3(NH 4) 2 SO 4 3)H 2 S+Pb(NO 3) 2 =PbS↓+2HNO 3 4)PbS+4H 2 O 2 =PbSO 4 +4H 2 O |
1)2Al+3S Al 2 S 3 2)Al 2 S 3 +6H 2 O=2Al(OH) 3 ↓+3H 2 S 3)Al(OH) 3 +KOH=K 4)3K+AlCl 3 =3KCl+Al(OH) 3 ↓ |
1)KNO 3 +Pb KNO 2 +PbO 2)2KNO 2 +2H 2 SO 4 +2KI=2K 2 SO 4 + 2NO+I 2 +2H 2 O 3)I 2 +10HNO 3 2HIO 3 +10NO 2 +4H 2 O 4)10NO 2 +P=2P 2 O 5 +10NO |
|
1)3Cu+8HNO 3 =3Cu(NO 3) 2 +2NO+4H 2 O 4)(OH) 2 +3H 2 SO 4 = CuSO 4 +2(NH 4) 2 SO 4 + 2H 2 O |
1)4Mg+10HNO 3 = 4Mg(NO 3) 2 +NH 4 NO 3 + 3H 2 O 2) Mg(NO 3) 2 +2KOH=Mg(OH) 2 ↓+2KNO 3 3)NH 4 NO 3 +KOHKNO 3 +NH 3 +H 2 O 4)4NH 3 +3O 2 =2N 2 +6H 2 O |
1)KNO 2 +NH 4 Cl KCl+N 2 +2H 2 O 2)3Mg+N 2 =Mg 3 N 2 3)Mg 3 N 2 +8HCl=3MgCl 2 +2NH 4 Cl 4)2MgCl 2 +2Na 2 CO 3 +H 2 O= (MgOH) 2 CO 3 ↓+ CO 2 +4NaCl |
|
1)Al 2 O 3 +2NaOH 2NaAlO 2 +H 2 O 2)NaAlO 2 +NH 4 Cl+H 2 O=NaCl+ Al(OH) 3 ↓+NH 3 3)2NH 3 +H 2 SO 4 =(NH 4) 2 SO 4 4)(NH 4) 2 SO 4 NH 3 +NH 4 HSO 4 |
1)3Cl 2 +6KOH6KCl+KClO 3 +3H 2 O 2)6HCl+KClO 3 =KCl+3Cl 2 +3H 2 O 3)2Fe+3Cl 2 =2FeCl 3 4)2FeCl 3 +Fe3FeCl 2 |
1)3Cu+4HNO 3 =3Cu(NO 3) 2 +2NO 2 +4H 2 O 2)Cu(NO 3) 2 +2NH 3 H 2 O=Cu(OH) 2 + 2NH 4 NO 3 3)Cu(OH) 2 +4NH 3 H 2 O =(OH) 2 + 4H 2 O 4)(OH) 2 +6HCl= CuCl 2 +4NH 4 Cl + 2H 2 O |
|
19 Документ C 2 Реакции , подтверждающие взаимосвязь различных классов неорганических веществ Даны водные растворы... Напишите уравнения четырех возможных реакций . Даны вещества : бромоводородная кислота, ... в осадок в ходе реакции вещество желтого цвета сожгли на... Сводный отчет председателей предметных комиссий Астраханской области по учебным предметам государственной итоговой аттестации по образовательным программам среднего общего образованияОтчет4 21.9 40.6 С2 Реакции , подтверждающие взаимосвязь различных классов неорганических веществ 54.1 23.9 9.9 7.7 4.3 С3 Реакции , подтверждающие взаимосвязь органических соединений 56.8 10 ... Календарно-тематическое планирование занятиЙ по подготовке к егэ по химии в 2013−2014 учебном году ПредметКалендарно-тематическое планирование25) 27.03.2014 Реакции , подтверждающие взаимосвязь различных классов неорганических веществ . Решение упражнений С-2 ... простых веществ . Химические свойства сложных веществ . Взаимосвязь различных классов неорганических веществ . Реакции ионного обмена... Календарно-тематический план занятий по подготовке к егэ по химии выпускников школ г. Барнаула и Алтайского края в 2015 г. Номер занятияКалендарно-тематический план... (на примере соединений алюминия и цинка). Взаимосвязь неорганических веществ . Реакции , подтверждающие взаимосвязь различных классов неорганических веществ (37 (С2)). 28 февраля 2015 ... |
Пособие-репетитор по химии
ЗАНЯТИЕ 10
10-й класс
(первый год обучения)
Продолжение. Начало см. в № 22/2005; 1, 2, 3, 5, 6, 8, 9, 11/2006
Окислительно-восстановительные реакции
План
1. Окислительно-восстановительные реакции (ОВР), степень окисления.
2. Процесс окисления, важнейшие восстановители.
3. Процесс восстановления, важнейшие окислители.
4. Окислительно-восстановительная двойственность.
5. Основные типы ОВР (межмолекулярные, внутримолекулярные, диспропорционирование).
6. Значение ОВР.
7. Методы составления уравнений ОВР (электронный и электронно-ионный баланс).
Все химические реакции по признаку изменения степеней окисления участвующих в них атомов можно разделить на два типа: ОВР (протекающие с изменением степеней окисления) и не ОВР.
Степень окисления – условный заряд атома в молекуле, рассчитанный, исходя из предположения, что в молекуле существуют только ионные связи.
П р а в и л а д л я о п р е д е л е н и я с т е п е н е й о к и с л е н и я
Степень окисления атомов простых веществ равна нулю.
Сумма степеней окисления атомов в сложном веществе (в молекуле) равна нулю.
Степень окисления атомов щелочных металлов +1.
Степень окисления атомов щелочно-земельных металлов +2.
Степень окисления атомов бора, алюминия +3.
Степень окисления атомов водорода +1 (в гидридах щелочных и щелочно-земельных металлов –1).
Степень окисления атомов кислорода –2 (в пероксидах –1).
Любая ОВР представляет собой совокупность процессов отдачи и присоединения электронов.
Процесс отдачи электронов называют окислением. Частицы (атомы, молекулы или ионы), отдающие электроны, называют восстановителями. В результате окисления степень окисления восстановителя увеличивается. Восстановителями могут быть частицы в низшей или промежуточной степенях окисления. Важнейшими восстановителями являются: все металлы в виде простых веществ, особенно активные; C, CO, NH 3 , PH 3 , CH 4 , SiH 4 , H 2 S и сульфиды, галогеноводороды и галогениды металлов, гидриды металлов, нитриды и фосфиды металлов.
Процесс присоединения электронов называют восстановлением. Частицы, принимающие электроны, называют окислителями. В результате восстановления степень окисления окислителя уменьшается. Окислителями могут быть частицы в высшей или промежуточной степенях окисления. Важнейшие окислители: простые вещества-неметаллы, обладающие высокой электроотрицательностью (F 2 , Cl 2 , O 2), перманганат калия, хроматы и дихроматы, азотная кислота и нитраты, концентрированная серная кислота, хлорная кислота и перхлораты.
Различают три типа окислительно-восстановительных реакций.
Межмолекулярные ОВР – окислитель и восстановитель входят в состав различных веществ, например:

Внутримолекулярные ОВР – окислитель и восстановитель входят в состав одного вещества. Это могут быть разные элементы, например:

или один химический элемент в разных степенях окисления, например:

Диспропорционирование (самоокисление-самовосстановление) – окислителем и восстановителем является один и тот же элемент, находящийся в промежуточной степени окисления, например:

ОВР имеют огромное значение, поскольку большинство реакций, протекающих в природе, относятся к этому типу (процесс фотосинтеза, горение). Кроме того, ОВР активно используются человеком в его практической деятельности (восстановление металлов, синтез аммиака):

Для составления уравнений ОВР можно использовать метод электронного баланса (электронных схем) или метод электронно-ионного баланса.
Метод электронного баланса:

Метод электронно-ионного баланса:

Тест по теме «Окислительно-восстановительные реакции»
1. Дихромат калия обработали сернистым газом в сернокислом растворе, а затем водным раствором сульфида калия. Конечным веществом Х является:
а) хромат калия; б) оксид хрома(III);
в) гидроксид хрома(III); г) сульфид хрома(III).
2. Какой продукт реакции между перманганатом калия и бромоводородной кислотой может реагировать с сероводородом?
а) Бром; б) бромид марганца(II);
в) диоксид марганца; г) гидроксид калия.
3. При окислении йодида железа(II) азотной кислотой образуются йод и монооксид азота. Чему равно отношение коэффициента при окислителе к коэффициенту при восстановителе в уравнении этой реакции?
а) 4: 1; б) 8: 3; в) 1: 1; г) 2: 3.
4. Степень окисления атома углерода в гидрокарбонат-ионе равна:
а) +2; б) –2; в) +4; г) +5.
5. Перманганат калия в нейтральной среде восстанавливается до:
а) марганца; б) оксида марганца(II);
в) оксида марганца(IV); г) манганата калия.
6. Сумма коэффициентов в уравнении реакции диоксида марганца с концентрированной соляной кислотой равна:
а) 14; б) 10; в) 6; г) 9.
7. Из перечисленных соединений только окислительную способность проявляют:
а) серная кислота; б) сернистая кислота;
в) сероводородная кислота; г) сульфат калия.
8. Из перечисленных соединений окислительно-восстановительную двойственность проявляют:
а) пероксид водорода; б) пероксид натрия;
в) сульфит натрия; г) сульфид натрия.
9. Из перечисленных ниже типов реакций окислительно-восстановительными являются реакции:
а) нейтрализации; б) восстановления;
в) диспропорционирования; г) обмена.
10. Степень окисления атома углерода численно не совпадает с его валентностью в веществе:
а) тетрахлорид углерода; б) этан;
в) карбид кальция; г) угарный газ.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| в | а | а | в | в | г | а, г | а, б, в | б, в | б, в |
Упражнения по
окислительно-восстановительным реакциям
(электронный и электронно-ионный баланс)
Задание 1. Составить уравнения ОВР с помощью метода электронного баланса, определить тип ОВР.
1. Цинк + дихромат калия + серная кислота = сульфат цинка + сульфат хрома(III) + сульфат калия + вода.
Электронный баланс:

2. Сульфат олова(II) + перманганат калия + серная кислота = сульфат олова(IV) + сульфат марганца + сульфат калия + вода.
3. Йодид натрия + перманганат калия + гидроксид калия = йод + манганат калия + гидроксид натрия.
4. Сера + хлорат калия + вода = хлор + сульфат калия + серная кислота.
5. Йодид калия + перманганат калия + серная кислота = сульфат марганца(II) + йод + сульфат калия + вода.
6. Сульфат железа(II) + дихромат калия + серная кислота = сульфат железа(III) + сульфат хрома(III) + сульфат калия + вода.
7. Нитрат аммония = оксид азота(I) + вода.
8. Фосфор + азотная кислота = фосфорная кислота + оксид азота(IV) + вода.
9. Азотистая кислота = азотная кислота + оксид азота(II) + вода.
10. Хлорат калия + соляная кислота = хлор + хлорид калия + вода.
11. Дихромат аммония = азот + оксид хрома(III) + вода.
12. Гидроксид калия + хлор = хлорид калия + хлорат калия + вода.
13. Оксид серы(IV) + бром + вода = серная кислота + бромоводородная кислота.
14. Оксид серы(IV) + сероводород = сера + вода.
15. Сульфит натрия = сульфид натрия + сульфат натрия.
16. Перманганат калия + соляная кислота = хлорид марганца(II) + хлор + хлорид калия + вода.
17. Ацетилен + кислород = углекислый газ + вода.
18. Нитрит калия + перманганат калия + серная кислота = нитрат калия + сульфат марганца(II) + сульфат калия + вода.
19. Кремний + гидроксид калия + вода = силикат калия + водород.
20. Платина + азотная кислота + соляная кислота = хлорид платины(IV) + оксид азота(II) + вода.
21. Сульфид мышьяка + азотная кислота = мышьяковая кислота + сернистый газ + диоксид азота + вода.
22. Перманганат калия = манганат калия + оксид марганца(IV) + кислород.
23.
Сульфид меди(I) + кислород + карбонат
кальция = оксид меди(II) + сульфит кальция +
+ углекислый газ.
24.
Хлорид железа(II) + перманганат калия +
соляная кислота = хлорид железа(III) + хлор +
+ хлорид марганца(II) + хлорид калия + вода.
25. Сульфит железа(II) + перманганат калия + серная кислота = сульфат железа(III) + сульфат марганца(II) + сульфат калия + вода.
Ответы на упражнения задания 1


При использовании метода полуреакций (электронно-ионный баланс) следует иметь в виду, что в водных растворах связывание избыточного кислорода и присоединение кислорода восстановителем происходит по-разному в кислой, нейтральной и щелочной средах. В кислых растворах избыток кислорода связывается протонами с образованием молекул воды, а в нейтральных и щелочных – молекулами воды с образованием гидроксид-ионов. Присоединение кислорода восстановителем осуществляется в кислой и нейтральной средах за счет молекул воды с образованием ионов водорода, а в щелочной среде – за счет гидроксид-ионов с образованием молекул воды.
Нейтральная среда:
окислитель + Н 2 О = … + ОН – ,
восстановитель + ОН – = … + Н 2 О.
Кислая среда:
окислитель + Н + = … + Н 2 О,
восстановитель + Н 2 О = … + Н + .
Задание 2. С помощью метода электронно-ионного баланса составить уравнения ОВР, протекающих в определенной среде.
1. Сульфит натрия + перманганат калия + вода = ...................... .
2. Гидроксид железа(II) + кислород + вода = ............................... .
3. Бромид натрия + перманганат калия + вода = ......................... .
4. Сероводород + бром + вода = серная кислота + ...................... .
5. Нитрат серебра(I) + фосфин + вода = серебро + фосфорная кислота + .............................. .
В щ е л о ч н о й с р е д е
1. Сульфит натрия + перманганат калия + гидроксид калия = ...................... .
2. Бромид калия + хлор + гидроксид калия = бромат калия + ...................... .
3. Сульфат марганца(II) + хлорат калия + гидроксид калия = манганат калия + ...................... .
4. Хлорид хрома(III) + бром + гидроксид калия = хромат калия + ...................... .
5. Оксид марганца(IV) + хлорат калия + гидроксид калия = манганат калия + ...................... .
В к и с л о й с р е д е
1. Сульфит натрия + перманганат калия + серная кислота = ...................... .
2. Нитрит калия + йодид калия + серная кислота = оксид азота (II) + ...................... .
3. Перманганат калия + оксид азота(II) + серная кислота = оксид азота(IV) + ...................... .
4. Йодид калия + бромат калия + соляная кислота = ...................... .
5. Нитрат марганца(II) + оксид свинца(IV) + азотная кислота = марганцовая кислота +
+ ...................... .
Ответы на упражнения задания 2
В н е й т р а л ь н о й с р е д е

Задание 3. С помощью метода электронно-ионного баланса составить уравнения ОВР.
1. Гидроксид марганца(II) + хлор + гидроксид калия = оксид марганца(IV) + ...................... .
Электронно-ионный баланс:

2. Оксид марганца(IV) + кислород + гидроксид калия = манганат калия +...................... .
3. Сульфат железа(II) + бром + серная кислота = ...................... .
4. Йодид калия + сульфат железа(III) = ....................... .
5. Бромоводород + перманганат калия = ............................. .
6. Хлороводород + оксид хрома(VI) = хлорид хрома(III) + ...................... .
7. Аммиак + бром = ...................... .
8. Оксид меди(I) + азотная кислота = оксид азота(II) + ...................... .
9. Сульфид калия + манганат калия + вода = сера + ...................... .
10. Оксид азота(IV) + перманганат калия + вода = ...................... .
11. Йодид калия + дихромат калия + серная кислота = ............................. .
12. Сульфид свинца(II) + пероксид водорода = ............................ .
13. Хлорноватистая кислота + пероксид водорода = соляная кислота + ...................... .
14. Йодид калия + пероксид водорода = .............................. .
15. Перманганат калия + пероксид водорода = оксид марганца(IV) + ................................... .
16. Йодид калия + нитрит калия + уксусная кислота = оксид азота(II) + ............................... .
17. Перманганат калия + нитрит калия + серная кислота = ................................. .
18. Сернистая кислота + хлор + вода = серная кислота + ...................... .
19. Сернистая кислота + сероводород = сера + ............................. .
В 2012 году предложена новая форма задания С2 — в виде текста, описывающего последовательность экспериментальных действий, которые нужно превратить в уравнения реакций.
Трудность такого задания состоит в том, что школьники очень плохо представляют себе экспериментальную, не бумажную химию, не всегда понимают используемые термины и протекающие процессы. Попробуем разобраться.
Очень часто понятия, которые химику кажутся совершенно ясными, абитуриентами воспринимаются неправильно, не так, как предполагалось. В словаре приведены примеры неправильного понимания.
Словарь непонятных терминов.
- Навеска — это просто некоторая порция вещества определенной массы (её взвесили на весах ). Она не имеет никакого отношения к навесу над крыльцом.
- Прокалить — нагреть вещество до высокой температуры и греть до окончания химических реакций. Это не «смешивание с калием» и не «прокалывание гвоздём».
- «Взорвали смесь газов» — это значит, что вещества прореагировали со взрывом. Обычно для этого используют электрическую искру. Колба или сосуд при этом не взрываются !
- Отфильтровать — отделить осадок от раствора.
- Профильтровать — пропустить раствор через фильтр, чтобы отделить осадок.
- Фильтрат — это профильтрованный раствор .
- Растворение вещества — это переход вещества в раствор. Оно может происходить без химических реакций (например, при растворении в воде поваренной соли NaCl получается раствор поваренной же соли NaCl, а не щелочь и кислота отдельно), либо в процессе растворения вещество реагирует с водой и образует раствор другого вещества (при растворении оксида бария получится раствор гидроксида бария). Растворять можно вещества не только в воде, но и в кислотах, в щелочах и т.д.
- Выпаривание — это удаление из раствора воды и летучих веществ без разложения содержащихся в растворе твёрдых веществ.
- Упаривание — это просто уменьшение массы воды в растворе с помощью кипячения.
- Сплавление — это совместное нагревание двух или более твёрдых веществ до температуры, когда начинается их плавление и взаимодействие. С плаванием по реке ничего общего не имеет.
- Осадок и остаток.
Очень часто путают эти термины. Хотя это совершенно разные понятия.
«Реакция протекает с выделением осадка» — это означает, что одно из веществ, получающихся в реакции, малорастворимо. Такие вещества выпадают на дно реакционного сосуда (пробирки или колбы).
«Остаток» — это вещество, которое осталось , не истратилось полностью или вообще не прореагировало. Например, если смесь нескольких металлов обработали кислотой, а один из металлов не прореагировал — его могут назвать остатком . - Насыщенный
раствор — это раствор, в котором при данной температуре концентрация вещества максимально возможная и больше уже не растворяется.
Ненасыщенный раствор — это раствор, концентрация вещества в котором не является максимально возможной, в таком растворе можно дополнительно растворить ещё какое-то количество данного вещества, до тех пор, пока он не станет насыщенным.
Разбавленный и «очень» разбавленный раствор — это весьма условные понятия, скорее качественные, чем количественные. Подразумевается, что концентрация вещества невелика.
Для кислот и щелочей также используют термин «концентрированный» раствор. Это тоже характеристика условная. Например, концентрированная соляная кислота имеет концентрацию всего около 40%. А концентрированная серная — это безводная, 100%-ная кислота.
Для того, чтобы решать такие задачи, надо чётко знать свойства большинства металлов, неметаллов и их соединений: оксидов, гидроксидов, солей. Необходимо повторить свойства азотной и серной кислот, перманганата и дихромата калия, окислительно-восстановительные свойства различных соединений, электролиз растворов и расплавов различных веществ, реакции разложения соединений разных классов, амфотерность, гидролиз солей и других соединений, взаимный гидролиз двух солей.
Кроме того, необходимо иметь представление о цвете и агрегатном состоянии большинства изучаемых веществ — металлов, неметаллов, оксидов, солей.
Именно поэтому мы разбираем этот вид заданий в самом конце изучения общей и неорганической химии.
Рассмотрим несколько примеров подобных заданий.
Пример 1: Продукт взаимодействия лития с азотом обработали водой. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали хлоридом бария. Раствор профильтровали, а фильтрат смешали с раствором нитрита натрия и нагрели.
Решение:
- Литий реагирует с азотом при комнатной температуре, образуя твёрдый нитрид лития:
6Li + N 2 = 2Li 3 N - При взаимодействии нитридов с водой образуется аммиак:
Li 3 N + 3H 2 O = 3LiOH + NH 3 - Аммиак реагирует с кислотами, образуя средние и кислые соли. Слова в тексте «до прекращения химических реакций» означают, что образуется средняя соль, ведь первоначально получившаяся кислая соль далее будет взаимодействовать с аммиаком и в итоге в растворе будет сульфат аммония:
2NH 3 + H 2 SO 4 = (NH 4) 2 SO 4 - Обменная реакция между сульфатом аммония и хлоридом бария протекает с образованием осадка сульфата бария:
(NH 4) 2 SO 4 + BaCl 2 = BaSO 4 + 2NH 4 Cl - После удаления осадка фильтрат содержит хлорид аммония, при взаимодействии которого с раствором нитрита натрия выделяется азот, причём эта реакция идёт уже при 85 градусах:
Пример 2: Навеску алюминия растворили в разбавленной азотной кислоте, при этом выделялось газообразное простое вещество. К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили , фильтрат упарили , полученный твёрдый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь.
Решение:
- Алюминий окисляется азотной кислотой, образуя нитрат алюминия. А вот продукт восстановления азота может быть разным, в зависимости от концентрации кислоты. Но надо помнить, что при взаимодействии азотной кислоты с металлами не выделяется водород
! Поэтому простым веществом может быть только азот:
10Al + 36HNO 3 = 10Al(NO 3) 3 + 3N 2 + 18H 2 O - В растворе остался нитрат натрия. При его сплавлении с солями аммония идёт окислительно-восстановительная реакция и выделяется оксид азота (I) (такой же процесс происходит при прокаливании нитрата аммония):
NaNO 3 + NH 4 Cl = N 2 O + 2H 2 O + NaCl - Оксид азота (I) — является активным окислителем, реагирует с восстановителями, образуя азот:
3N 2 O + 2NH 3 = 4N 2 + 3H 2 O
Пример 3: Оксид алюминия сплавили с карбонатом натрия, полученное твёрдое вещество растворили в воде. Через полученный раствор пропускали сернистый газ до полного прекращения взаимодействия. Выпавший осадок отфильтровали, а к профильтрованному раствору прибавили бромную воду. Полученный раствор нейтрализовали гидроксидом натрия.
Решение:
- Оксид алюминия — амфотерный оксид, при сплавлении со щелочами или карбонатами щелочных металлов образует алюминаты:
Al 2 O 3 + Na 2 CO 3 = 2NaAlO 2 + CO 2 - Алюминат натрия при растворении в воде образует гидроксокомплекс:
NaAlO 2 + 2H 2 O = Na - Растворы гидроксокомплексов реагируют с кислотами и кислотными оксидами в растворе, образуя соли. Однако, сульфит алюминия в водном растворе не существует, поэтому будет выпадать осадок гидроксида алюминия. Обратите внимание, что в реакции получится кислая соль — гидросульфит калия:
Na + SO 2 = NaHSO 3 + Al(OH) 3 - Гидросульфит калия является восстановителем и окисляется бромной водой до гидросульфата:
NaHSO 3 + Br 2 + H 2 O = NaHSO 4 + 2HBr - Полученный раствор содержит гидросульфат калия и бромоводородную кислоту. При добавлении щелочи нужно учесть взаимодействие с ней обоих веществ:
NaHSO 4 + NaOH = Na 2 SO 4 + H 2 O
HBr + NaOH = NaBr + H 2 O
Пример 4: Сульфид цинка обработали раствором соляной кислоты, полученный газ пропустили через избыток раствора гидроксида натрия, затем добавили раствор хлорида железа (II). Полученный осадок подвергли обжигу. Полученный газ смешали с кислородом и пропустили над катализатором.
Решение:
- Сульфид цинка реагирует с соляной кислотой, при этом выделяется газ — сероводород:
ZnS + HCl = ZnCl 2 + H 2 S - Сероводород — в водном растворе реагирует со щелочами, образуя кислые и средние соли. Поскольку в задании говорится про избыток гидроксида натрия, следовательно, образуется средняя соль — сульфид натрия:
H 2 S + NaOH = Na 2 S + H 2 O - Сульфид натрия реагирует с хлоридом двухвалентного железа, образуется осадок сульфида железа (II):
Na 2 S + FeCl 2 = FeS + NaCl - Обжиг — это взаимодействие твёрдых веществ с кислородом при высокой температуре. При обжиге сульфидов выделяется сернистый газ и образуется оксид железа (III):
FeS + O 2 = Fe 2 O 3 + SO 2 - Сернистый газ реагирует с кислородом в присутствии катализатора, образуя серный ангидрид:
SO 2 + O 2 = SO 3
Пример 5: Оксид кремния прокалили с большим избытком магния. Полученную смесь веществ обработали водой. При этом выделился газ, который сожгли в кислороде. Твёрдый продукт сжигания растворили в концентрированном растворе гидроксида цезия. К полученному раствору добавили соляную кислоту.
Решение:
- При восстановлении оксида кремния магнием образуется кремний, который реагирует с избытком магния. При этом получается силицид магния:
SiO 2 + Mg = MgO + Si
Si + Mg = Mg 2 SiМожно записать при большом избытке магния суммарное уравнение реакции:
SiO 2 + Mg = MgO + Mg 2 Si - При растворении в воде полученной смеси растворяется силицид магния, образуется гидроксид магния и силан (окисд магния реагирует с водой только при кипячении):
Mg 2 Si + H 2 O = Mg(OH) 2 + SiH 4 - Силан при сгорании образует оксид кремния:
SiH 4 + O 2 = SiO 2 + H 2 O - Оксид кремния — кислотный оксид, он реагирует со щелочами, образуя силикаты:
SiO 2 + CsOH = Cs 2 SiO 3 + H 2 O - При действии на растворы силикатов кислот, более сильных, чем кремниевая, она выделяется в виде осадка:
Cs 2 SiO 3 + HCl = CsCl + H 2 SiO 3
Задания для самостоятельной работы.
- Нитрат меди прокалили, полученный твёрдый осадок растворили в серной кислоте. Через раствор пропустили сероводород, полученный чёрный осадок подвергли обжигу, а твёрдый остаток растворили при нагревании в концентрированной азотной кислоте.
- Фосфат кальция сплавили с углём и песком, затем полученное простое вещество сожгли в избытке кислорода, продукт сжигания растворили в избытке едкого натра. К полученному раствору прилили раствор хлорида бария. Полученный осадок обработали избытком фосфорной кислоты.
- Медь растворили в концентрированной азотной кислоте, полученный газ смешали с кислородом и растворили в воде. В полученном растворе растворили оксид цинка, затем к раствору прибавили большой избыток раствора гидроксида натрия.
- На сухой хлорид натрия подействовали концентрированной серной кислотой при слабом нагревании, образующийся газ пропустили в раствор гидроксида бария. К полученному раствору прилили раствор сульфата калия. Полученный осадок сплавили с углем. Полученное вещество обработали соляной кислотой.
- Навеску сульфида алюминия обработали соляной кислотой. При этом выделился газ и образовался бесцветный раствор. К полученному раствору добавили раствор аммиака, а газ пропустили через раствор нитрата свинца. Полученный при этом осадок обработали раствором пероксида водорода.
- Порошок алюминия смешали с порошком серы, смесь нагрели, полученное вещество обработали водой, при этом выделился газ и образовался осадок, к которому добавили избыток раствора гидроксида калия до полного растворения. Этот раствор выпарили и прокалили. К полученному твёрдому веществу добавили избыток раствора соляной кислоты.
- Раствор иодида калия обработали раствором хлора. Полученный осадок обработали раствором сульфита натрия. К полученному раствору прибавили сначала раствор хлорида бария, а после отделения осадка — добавили раствор нитрата серебра.
- Серо-зелёный порошок оксида хрома (III) сплавили с избытком щёлочи, полученное вещество растворили в воде, при этом получился тёмно-зелёный раствор. К полученному щелочному раствору прибавили пероксид водорода. Получился раствор желтого цвета, который при добавлении серной кислоты приобретает оранжевый цвет. При пропускании сероводорода через полученный подкисленный оранжевый раствор он мутнеет и вновь становится зелёным.
- (МИОО 2011, тренинговая работа) Алюминий растворили в концентрированном растворе гидроксида калия. Через полученный раствор пропускали углекислый газ до прекращения выделения осадка. Осадок отфильтровали и прокалили. Полученный твердый остаток сплавили с карбонатом натрия.
- (МИОО 2011, тренинговая работа) Кремний растворили в концентрированном растворе гидроксида калия. К полученному раствору добавили избыток соляной кислоты. Помутневший раствор нагрели. Выделившийся осадок отфильтровали и прокалили с карбонатом кальция. Напишите уравнения описанных реакций.
разованием воды. Раствор, полученный после пропускания газов через воду, имел кислую реакцию. При обработке этого раствора нитратом серебра выпало 14,35 г белого осадка. Определить количественный и качественный состав исходной смеси газов. Решение.
Газ, который горит с образованием воды, - водород, он мало растворим в воде. Реагируют на солнечном свету со взрывом водород с кислородом, водород с хлором. Очевидно, что в смеси с водородом был хлор, т.к. образующийся НС1 хорошо растворим в воде и с AgN03 дает белый осадок.
Таким образом, смесь состоит из газов Н2 и С1:
1 моль 1 моль
НС1 + AgN03 -» AgCl 4- HN03.
х моль 14,35
При обработке 1 моль НС1 образуется 1 моль AgCl, а при обработке х моль 14,35 г или 0,1 моль. Mr(AgCl) = 108 + 2 4- 35,5 = 143,5, M(AgCl) = 143,5 г/моль,
v= - = = 0,1 моль,
х = 0,1 моль НС1 содержалось в растворе. 1 моль 1 моль 2 моль Н2 4- С12 2НС1 х моль у моль 0,1 моль
х = у = 0,05 моль (1,12 л) водорода и хлора вступило в реакцию при образовании 0,1 моль
НС1. В смеси было 1,12 л хлора, а водорода 1,12 л + 1,12 л (избыток) = 2,24 л.
Пример 6. В лаборатории имеется смесь хлорида и йодида натрия. 104,25 г этой смеси растворили в воде и пропустили через полученный раствор избыток хлора, затем раствор выпарили досуха и остаток прокалили до постоянной массы при 300 °С.
Масса сухого вещества оказалось равной 58,5 г. Определить состав исходной смеси в процентах.
Mr(NaCl) = 23 + 35,5 = 58,5, M(NaCl) = 58,5 г/моль, Mr(Nal) = 127 + 23 = 150 M(Nal) = 150 г/моль.
В исходной смеси: масса NaCl - х г, масса Nal - (104,25 - х) г.
При пропускании через раствор хлорида и йодида натрия йод вытесняется им. При пропускании сухого остатка йод испарился. Таким образом, сухим веществом может быть только NaCl.
В полученном веществе: масса NaCl исходного х г, масса полученного (58,5-х):
2 150 г 2 58,5 г
2NaI + С12 -> 2NaCl + 12
(104,25 - х) г (58,5 - х) г
2 150 (58,5 - х) = 2 58,5 (104,25-х)
х = - = 29,25 (г),
т.е. NaCl в смеси было 29,25 г, a Nal - 104,25 -- 29,25 = 75 (г).
Найдем состав смеси (в процентах):
w(Nal) = 100 % = 71,9 %,
©(NaCl) = 100 % - 71,9 % = 28,1 %.
Пример 7. 68,3 г смеси нитрата, йодида и хлорида калия растворено в воде и обработано хлорной водой. В результате выделилось 25,4 г йода (растворимостью которого в воде пренебречь). Такой же раствор обработан нитратом серебра. Выпало 75,7 г осадка. Определить состав исходной смеси.
С нитратом калия и хлоридом калия хлор не взаимодействует:
2KI + С12 -» 2КС1 + 12,
2 моль - 332 г 1 моль - 254 г
Мг(К1) = 127 + 39 - 166,
х = = 33,2 г (KI было в смеси).
v(KI) - - = = 0,2 моль.
1 моль 1 моль
KI + AgN03 = Agl + KN03.
0,2 моль х моль
х = = 0,2 моль.
Mr(Agl) = 108 + 127 = 235,
m(Agl) = Mv = 235 0,2 = 47 (r),
тогда AgCl будет
75,7 г - 47 г = 28,7 г.
74,5 г 143,5 г
KCl + AgN03 = AgCl + KN03
Х = 1 L_ = 14,9 (KCl).
Следовательно, в смеси было: 68,3 - 33,2 - 14,9 = 20,2 г KN03 .
Пример 8. На нейтрализацию 34,5 г олеума расходуется 74,5 мл 40%-ного раствора гидроксида калия. Сколько молей оксида серы (VI) приходится на 1моль серной кислоты?
100%-ная серная кислота растворяет оксид серы (VI) в любых соотношениях. Состав, выражаемый формулой H2S04*xS03, носит название олеума. Рассчитаем, сколько гидроксида калия необходимо для нейтрализации H2S04:
1 моль 2 моль
H2S04 + 2КОН -> K2S04 + 2Н20 xl моль у моль
у - 2*х1 моль КОН идет на нейтрализацию S03 в олеуме. Рассчитаем, сколько КОН необходимо для нейтрализации 1моль S03:
1 моль 2 моль
S03 4- 2КОН -> K2SO4 + Н20 х2 моль z моль
z - 2 x2 моль KOH идет на нейтрализацию SOg в олеуме. На нейтрализацию олеума идет 74,5 мл 40% -ного раствора КОН, т.е. 42 г или 0,75 моль КОН.
Следовательно, 2 xl + 2х 2 = 0,75,
98 xl + 80 х2 = 34,5 г,
xl = 0,25 моль H2S04,
х2 = 0,125 моль S03.
Пример 9. Имеется смесь карбоната кальция, сульфида цинка и хлорида натрия. Если на 40 г этой смеси подействовать избытком соляной кислоты, выделится 6,72 л газов, при взаимодействии которых с избытком оксида серы (IV) выделяется 9,6 г осадка. Определить состав смеси.
При действии на смесь избытка соляной кислоты могли выделиться оксид углерода (IV) и сероводород. С оксидом серы (IV) взаимодействует только сероводород, поэтому по количеству выделившегося осадка можно рассчитать его объем:
СаС03 + 2НС1 -> СаС12 + Н20 + C02t(l)
100 г - 1 моль 22,4 л - 1 моль
ZnS + 2НС1 -> ZnCl2 + H2St (2)
97 г - 1 моль 22,4 л - 1 моль
44,8 л - 2 моль 3 моль
2H2S + S02 -» 3S + 2Н20 (3)
xl л 9,6 г (0,3 моль)
xl = 4,48 л (0,2 моль) H2S; из уравнений (2 - 3) видно, что ZnS было 0,2 моль (19,4 г):
2H2S + S02 -> 3S + 2Н20.
Очевидно, что оксида углерода (IV) в смеси было:
6,72 л - 4,48 л = 2,24 л (С02).