Reakcije koje potvrđuju vezu između različitih klasa neorganskih supstanci (2) - Dokument. Nastavnik hemije Rastvor kalijum jodida i hlorne vode
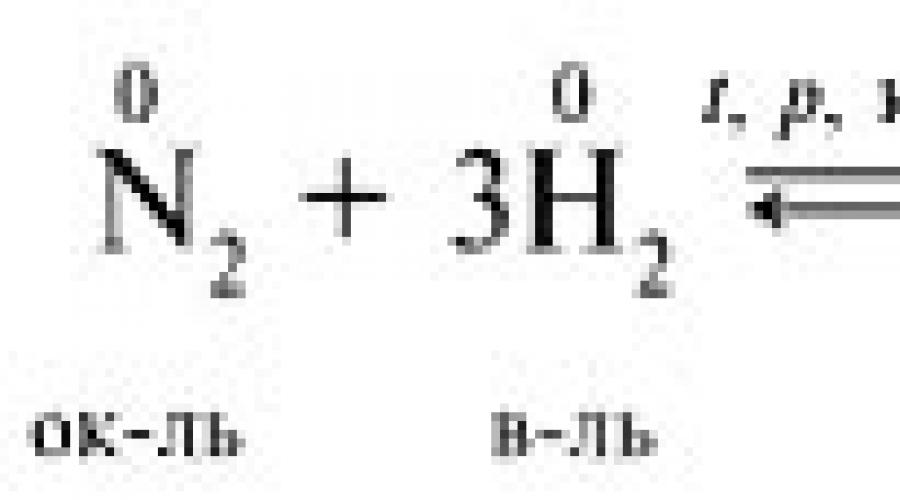
Pročitajte također
Rješenje:
2Cl2 + 2H2O = 4HCl + O2
mp-pa = m(H2O) + m(Cl2) − m(O2) ;
Δm = m(Cl2) − m(O2) ;
Uzmimo da je n(Cl2). X, tada je n(O2) = 0,5x;
Kreirajmo algebarsku jednačinu na osnovu gornje jednakosti i pronađimo X:
Δm = x M(Cl2) − 0,5x M(O2) = x(71 − 16) = 55x;
x = 0,04 mol;
V(Cl2) = n(Cl2) Vm = 0,004 22,4 = 0,896 l.
odgovor: 0.896 l.
10. Izračunajte raspon dopuštenih vrijednosti volumena klora (br.) koji je neophodan za potpuno hloriranje 10,0 g mješavine željeza i bakra.
Rješenje:
Budući da uvjet ne govori koliki je omjer metala u smjesi, možemo samo pretpostaviti da će raspon dopuštenih vrijednosti za volumen klora u ovom slučaju biti raspon između njegovih zapremina potrebnih za hloriranje 10 g svakog metal odvojeno. A rješavanje problema se svodi na sekvencijalno pronalaženje ovih volumena.
2Fe + 3Cl2 = 2FeCl3
Cu + Cl′2 = CuCl2
n(Cl2) = 1,5n(Fe) = 1,5 10/56 = 0,26 mol;
V(Cl2) = n(Cl2) Vm = 0,26 22,4 = 5,99 ≈ 6 l;
n(Cl′2) = n(Cu) = 10/63,5 = 0,16 mol;
V(Cl′2) = 22,4 · 0,16 = 3,5 l.
odgovor: 3,5 ≤ V(Cl2) ≤ 6 l.
11. Izračunajte masu joda koja nastaje pri tretiranju mješavine natrijevog jodida dihidrata, kalijum jodida i magnezijum jodida viškom zakiseljene otopine kalijevog permanganata, u kojoj su maseni udjeli svih soli jednaki, a ukupna količina svih supstance je 50,0 mmol.
Rješenje:
Zapišimo jednadžbe reakcija koje se javljaju u otopini i sastavimo opće polu-reakcije na osnovu kojih ćemo rasporediti koeficijente:
10NaI 2H2O + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 5Na2SO4 + K2SO4 + 28H2O
10KI + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
5MgI2 + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 5MgSO4 + K2SO4 + 8H2O
MnO4¯+ 8H+ + 5ē = Mn2+ + 4H2O 2
2I¯− 2 ē = I2 5
2 MnO4¯+ 16H+ + 10 I¯= 2 Mn2+ + 5I2 + 8H2O
Iz jednakosti masenih udjela komponenti smjese slijedi da su i njihove mase jednake. Greška ih za X Napravimo algebarsku jednačinu zasnovanu na jednakosti:
n1 + n2 + n3 = 50,0 mmol
m1/M(NaI 2H2O) + m2/M(KI) + m3/M(MgI2) = 50,0 mmol
m1 = m2 = m3 = x
x/186 + x/166 + x/278 = 50 10-3 mol
m (I2)1 = 5M(I2) m(NaI 2H2O)/10M(NaI 2H2O) = (5 254 3,33)/10 186 = 2,27 g;
m (I2)2 = 5M(I2) m(KI)/10M(KI) = (5 254 3,33)/10 166 = 2,55 g;
m (I2)3 = 5M(I2) m(MgI2)/10M(MgI2) = (5 254 3,33)/10 278 = 3,04 g.
Ukupno: 7,86 g.
odgovor: 7,86 g.
12. Prilikom propuštanja hlora kroz 200 g 5,00% otopine vodikovog peroksida, masa otopine se povećala za 3,9 g Izračunajte masene udjele tvari u dobivenoj otopini.
Rješenje:
N2O2 + Cl2 = O2 + 2NCl
1. Pronađite početnu količinu H2O2 u otopini:
n1(H2O2) = m/M(H2O2) = mP-RA ω/ M(H2O2) = 200 0,05/34 =
2. Uzmimo količinu apsorbovanog hlora u rastvoru kao X, tada je nO2 = x, a povećanje mase rastvora je zbog razlike u masama apsorbovanog hlora i oslobođenog kiseonika:
m(Cl 2) − m(O 2) = Δ m ili x M(Cl 2) − x M(O2) = Δ m;
71x − 32x = 3,9; x = 0,1 mol.
3. Izračunajte količinu tvari preostale u otopini:
n2(H2O2)OKSIDIRAN = n(Cl2) = 0,1 mol;
n(H2O2) OSTAJE U RASTVORENI = n1 − n2 = 0,294 − 0,1 = 0,194 mol;
n(HCl) = 2n(Cl 2) = 0,2 mol.
4. Nađite masene udjele tvari u rezultirajućem rastvoru:
ω(H2O2) = n(H2O2) M(H2O2)/ mP-RA = 0,194 34/203,9 100% = 3,23%;
ω(HCl) = n(HCl) M(HCl)/mP-RA = 0,2 36,5/203,9 100% = 3,58%.
odgovor:ω(H2O2) = 3,23%;
ω(NCl) = 3,58%.
13. Mangan (II) bromid tetrahidrat mase 4,31 g rastvoren je u dovoljnoj količini vode. Klor je propuštan kroz nastalu otopinu sve dok molarne koncentracije obje soli nisu bile jednake. Izračunajte koliko je hlora (br.) propušteno.
Rješenje:
Mn Br2 4H2O + Cl2 = MnCl2 + Br2 + 4H2O
1. Pronađite početnu količinu mangan (II) bromid tetrahidrata u rastvoru:
n(Mn Br2 · 4H2O)REQ. = m/M = 4,31/287 = 1,5 10−2 mol.
2. Jednakost molarnih koncentracija obe soli će se desiti kada se potroši polovina početne količine Mn Br2 · 4H2O. To. potrebna količina hlora može se naći iz jednadžbe reakcije:
n(Cl2) = n(MnCl2) = 0,5 n(Mn Br2 · 4H2O) ref. = 7,5·10−3mol.
V(Cl2) = n·Vm = 7,5·10−3·22,4 = 0,168 l.
odgovor: 0.168 l.
14. Klor je propušten kroz 150 ml rastvora barijum bromida sa molarnom koncentracijom soli od 0,05 mol/l dok maseni udjeli obe soli nisu bili jednaki. Izračunajte koliko je klora (200C, 95 kPa) propušteno.
Rješenje:
BaBr2 + Cl2 = BaCl2 + Br2
1. Iz jednakosti masenih udjela nastalih soli slijedi jednakost njihovih masa.
m(BaCl2) = m(BaBr2) ili n(BaCl2) M(BaCl2) = n′(BaBr2) M(BaBr2).
2. Uzmimo n(BaCl2) kao X mol, i n′(BaBr2), koji ostaje u rastvoru, za SM ·V − x = 0,15·0,05− x = 7,5·10−3− x i sastavite algebarsku jednačinu:
208x = (7,5 10−3− x) 297;
2,2275 = 297x +208x;
3. Pronađite količinu hlora i njegovu zapreminu:
n(Cl2) = n(BaCl2) = 0,0044 mol;
V(Cl2) = nRT/P = (0,0044 8,314 293)/95 = 0,113 l.
odgovor: 113 ml.
15. Mješavina kalijum bromida i fluorida ukupne mase 100 g otopljena je u vodi; višak hlora je propušten kroz nastali rastvor. Masa ostatka nakon isparavanja i kalcinacije je 80,0 g Izračunajte masene udjele tvari u dobivenoj smjesi.
Rješenje:
1. Nakon kalcinacije produkta reakcije, ostatak se sastoji od kalijevog fluorida i klorida:
2KBr + Cl2 = 2KCl + Br2
2. Uzmimo iznose KF i KBr kao X I at shodno tome, onda
n(KCl) = n(KBr) = y mol.
Hajde da napravimo sistem jednačina zasnovan na jednakosti:
m(KF) + m(KBr) = 100
m(KF) + m(KCl) = 80
n(KF) M(KF) + n(KBr) M(KBr) = 100
n(KF) M(KF) + n(KCl) M(KCl) = 80
58x + 119y = 100 58x = 100 – 119y
58 x + 74,5y = 80 100 – 119y + 74,5y = 80
44,5y = 20; y = 0,45; x = 0,8.
3. Nađimo mase tvari u ostatku i njihove masene udjele:
m(KF) = 58·0,8 = 46,5 g.
m(KCl) = 74,5 0,45 = 33,5 g.
ω(KF) = 46,5/80·100% = 58,1%;
ω(KCl) = 33,5/80·100% = 41,9%.
odgovor:ω(KF) = 58,1%;
ω(KCl) = 41,9%.
16. Smjesa natrijum bromida i jodida je tretirana sa viškom hlorne vode, dobijeni rastvor je uparen i kalcinisan. Ispostavilo se da je masa suhog ostatka 2,363 puta manja od mase originalne smjese. Koliko će puta masa precipitata dobijenog nakon tretiranja iste smjese viškom srebrovog nitrata biti veća od mase prvobitne smjese?
Rješenje:
2NaBr + HClO +HCl = 2NaCl + Br2 + H2O
2NaI + HClO +HCl = 2NaCl + I2 + H2O
1. Uzmimo masu početne smjese kao 100 g, a količine soli NaBr i NaI koje je formiraju kao X I at respektivno. Zatim, na osnovu omjera (m(NaBr) + m(NaI))/m(NaCl) = 2,363, kreiramo sistem jednadžbi:
103x + 150y = 100
2.363·58.5(x+y) = 100
x = 0,54 mol; y = 0,18 mol.
2. Zapišimo drugu grupu reakcija:
NaBr + AgNO3 = AgBr↓ + NaNO3
NaI + AgNO3 = AgI↓ + NaNO3
Zatim, da bi se odredio omjer masa formiranog taloga i početne mješavine tvari (uzete kao 100 g), ostaje pronaći količine i mase AgBr i AgI, koje su jednake n(NaBr) i n( NaI), odnosno 0,18 i 0,54 mol.
3. Pronađite omjer mase:
(m(AgBr) + m(AgI))/(m(NaBr) + m(NaI)) =
(M(AgBr) x + M(AgI) y)/100 =
(188 0,18 + 235 0,54)/100 =
(126,9 + 34,67)/100 = 1,62.
odgovor: 1,62 puta.
17. Smjesa magnezijum jodida i cink jodida tretirana je viškom bromne vode, dobijeni rastvor je uparen i kalcinisan na 200 – 3000C. Ispostavilo se da je masa suhog ostatka 1,445 puta manja od mase originalne smjese. Koliko će puta masa precipitata dobijenog nakon tretiranja iste smjese viškom natrijevog karbonata biti manja od mase prvobitne smjese?
Rješenje:
1. Zapišimo obje grupe reakcija, označavajući mase početne smjese tvari i rezultirajućih proizvoda kao m1, m2, m3.
(MgI2 + ZnI2)+ 2Br2 = (MgBr2 + ZnBr2)+ 2I2
(MgI2 + ZnI2)+ 2 Na2CO3 = (MgCO3 + ZnCO3)↓ + 4NaI
m1/m2 = 1.445; m1/m3 = ?
2. Uzmimo količinu soli u početnoj smjesi kao X(MgI2) i at(ZnI2), tada se količine proizvoda svih reakcija mogu izraziti kao
n(MgI2) = n(MgBr2) = n(MgCO3) = x mol;
n(ZnI2) = n(ZnBr2) = n(ZnCO3) = y mol.
Zadaci C 2 (2013)
Reakcije koje potvrđuju odnos između različitih klasa neorganske supstance
Bakar(II) oksid je zagrejan u struji ugljen monoksida. Dobivena supstanca je spaljena u atmosferi hlora.
Produkt reakcije je otopljen u vodi.
Dobiveni rastvor je podeljen na dva dela. U jedan dio je dodat rastvor kalijum jodida, a u drugi rastvor srebrovog nitrata. U oba slučaja uočeno je stvaranje precipitata.
Napišite jednadžbe za četiri opisane reakcije.
Bakar nitrat je kalciniran, a nastala čvrsta supstanca je otopljena u razblaženoj sumpornoj kiselini. Otopina dobivene soli podvrgnuta je elektrolizi. Supstanca oslobođena na katodi je otopljena u koncentrovanoj dušičnoj kiselini.
Određena količina cink sulfida podijeljena je na dva dijela. Jedan od njih je tretiran azotnom kiselinom, a drugi je ispaljen na vazduh. Kada su oslobođeni plinovi stupili u interakciju, nastala je jednostavna supstanca. Ova supstanca je zagrijana s koncentriranom dušičnom kiselinom i oslobođen je smeđi plin. Napišite jednadžbe za četiri opisane reakcije.
Sumpor je topljen sa gvožđem. Produkt reakcije je otopljen u vodi. Otpušteni plin je spaljen u višku kisika.
Produkti sagorevanja su apsorbovani vodenim rastvorom gvožđe(III) sulfata.
Napišite jednadžbe za četiri opisane reakcije. Gvožđe je spaljeno u hloru. Dobivena sol je dodana u otopinu natrijevog karbonata i formirao se smeđi talog. Ovaj talog je filtriran i kalciniran. Dobivena supstanca je otopljena u jodovodonoj kiselini. Napišite jednadžbe za četiri opisane reakcije. Rastvor kalijum jodida tretiran je viškom hlorne vode i prvo je uočeno stvaranje taloga, a zatim njegovo potpuno otapanje. Dobivena kiselina koja je sadržavala jod je izolirana iz otopine, osušena i pažljivo zagrijana.
Rezultirajući oksid je reagirao sa
ugljični monoksid
. Zapišite jednadžbe za opisane reakcije.
Bakar je otopljen u razblaženoj azotnoj kiselini. U nastalu otopinu dodan je višak otopine amonijaka, pri čemu se prvo promatra stvaranje taloga, a zatim njegovo potpuno otapanje uz stvaranje tamnoplave otopine. Dobivena otopina tretirana je sumpornom kiselinom dok se ne pojavi karakteristična plava boja soli bakra. Zapišite jednadžbe za opisane reakcije.
Magnezijum je otopljen u razblaženoj azotnoj kiselini i nije uočeno razvijanje gasa. Dobijeni rastvor je tretiran viškom rastvora kalijum hidroksida uz zagrevanje. Otpušteni plin je spaljen u kisiku. Zapišite jednadžbe za opisane reakcije.
Mješavina praha kalijum nitrita i amonijum hlorida rastvorena je u vodi i rastvor je lagano zagrejan. Otpušteni gas je reagovao sa magnezijumom. Reakcioni proizvod je dodan u višak rastvora hlorovodonične kiseline i nije uočeno razvijanje gasa.
Dobivena magnezijeva sol u otopini tretirana je natrijum karbonatom. Zapišite jednadžbe za opisane reakcije.
Aluminijum oksid je fuzionisan sa natrijum hidroksidom.
Reakcioni proizvod je dodan u rastvor amonijum hlorida. Otpušteni plin oštrog mirisa apsorbira sumporna kiselina.
Dobivena srednja sol je kalcinirana. Zapišite jednadžbe za opisane reakcije.
|
Hlor je reagovao sa vrućim rastvorom kalijum hidroksida. Kako se otopina hladila, taložili su se kristali Bertoletove soli. Dobijeni kristali su dodani u rastvor hlorovodonične kiseline. Dobivena jednostavna supstanca reagirala je s metalnim željezom. Reakcioni proizvod je zagrejan sa novom porcijom gvožđa. Zapišite jednadžbe za opisane reakcije. Bakar je otopljen u koncentrovanoj azotnoj kiselini. Dobivenom rastvoru je dodan višak rastvora amonijaka, posmatrajući prvo stvaranje taloga, a zatim njegovo potpuno otapanje. Dobiveni rastvor je tretiran viškom hlorovodonične kiseline. Zapišite jednadžbe za opisane reakcije. Gvožđe je rastvoreno u vrućoj koncentrovanoj sumpornoj kiselini. Dobivena sol je tretirana viškom otopine natrijum hidroksida. Nastali smeđi talog je filtriran i kalciniran. Dobivena supstanca je spojena sa željezom. Napišite jednadžbe za četiri opisane reakcije. 1)CuO + CO=Cu+CO 2 |
2) Cu+Cl 2 = CuCl 2 3) 2CuCl 2 +2KI=2CuCl↓ +I 2 +2KCl 4) CuCl 2 +2AgNO 3 =2AgCl↓+Cu(NO 3) 2 1)Cu(NO 3) 2 2CuO+4NO 2 +O 2 |
2) CuO+2H 2 SO 4 =CuSO 4 +SO 2 +2H 2 O 3)CuSO 4 +H 2 O=Cu↓+H 2 SO 4 +O 2 (b. 4)Cu+4HNO 3 =Cu(NO 3) 2 +2NO 2 +2H 2 O |
|
1) 2Al+3I 2 = 2AlI 3 2) AlI 3 +3NaOH= Al(OH) 3 +3NaI 3)Al(OH) 3 + 3HCl= AlCl 3 + 3H 2 O 4)2AlCl 3 +3Na 2 CO 3 +3H 2 O=2Al(OH) 3 +3CO 2 +6NaCl |
2) Fe 2 O 3 +CO=Fe+CO 2 3)2Fe+6H 2 SO 4 =Fe 2 (SO 4) 3 +3SO 2 +6H 2 O 4)Fe 2 (SO 4) 3 +4H 2 O=2Fe+H 2 +3H 2 SO 4 +O 2 (elektroliza) |
1) ZnS+2HNO 3 =Zn(NO 3) 2 +H 2 S 2)2ZnS +3O 2 =2ZnO +2SO 2 3)2H 2 S+SO 2 =3S↓+2H 2 O 4)S+6HNO 3 =H 2 SO 4 +6NO 2 +2H 2 O |
|
2) FeS + 2H 2 O=Fe(OH) 2 +H 2 S 3)2H 2 S+3O 2 2SO 2 +2H 2 O 4)Fe 2 (SO 4) 3 +SO 2 +2H 2 O=2FeSO 4 + 2H 2 SO 4 |
2) CuO+2H 2 SO 4 =CuSO 4 +SO 2 +2H 2 O 2)2FeCl 3 +3Na 2 CO 3 =2Fe(OH) 3 +6NaCl+3CO 2 3) 2Fe(OH) 3 Fe 2 O 3 + 3H 2 O 4) Fe 2 O 3 + 6HI = 2FeI 2 + I 2 + 3H 2 O |
1)2KI+Cl 2 =2KCl+I 2 2)I 2 +5Cl 2 +6H 2 O=10HCl+2HIO 3 3)2HIO 3 I 2 O 5 + H 2 O 4) I 2 O 5 +5CO = I 2 +5CO 2 |
|
1)Cr 2 S 3 +3H 2 SO 4 =Cr 2 (SO 4) 3 +3H 2 S 2)Cr 2 (SO 4) 4 +6NH 3 +6H 2 O=2Cr(OH) 3 ↓+3(NH 4) 2 SO 4 3)H 2 S+Pb(NO 3) 2 =PbS↓+2HNO 3 4)PbS+4H 2 O 2 =PbSO 4 +4H 2 O |
1)2Al+3S Al 2 S 3 2)Al 2 S 3 +6H 2 O=2Al(OH) 3 ↓+3H 2 S 3)Al(OH)3 +KOH=K 4)3K+AlCl 3 =3KCl+Al(OH) 3 ↓ |
1)KNO 3 +Pb KNO 2 +PbO 2)2KNO 2 +2H 2 SO 4 +2KI=2K 2 SO 4 + 2NO+I 2 +2H 2 O 3)I 2 +10HNO 3 2HIO 3 +10NO 2 +4H 2 O 4)10NO 2 +P=2P 2 O 5 +10NO |
|
1)3Cu+8HNO 3 =3Cu(NO 3) 2 +2NO+4H 2 O 4)(OH) 2 +3H 2 SO 4 = CuSO 4 +2(NH 4) 2 SO 4 + 2H 2 O |
1)4Mg+10HNO3 = 4Mg(NO3)2 +NH4NO3 + 3H2O 2) Mg(NO 3) 2 +2KOH=Mg(OH) 2 ↓+2KNO 3 3)NH 4 NO 3 +KOHKNO 3 +NH 3 +H 2 O 4)4NH 3 +3O 2 =2N 2 +6H 2 O |
1)KNO 2 +NH 4 Cl KCl+N 2 +2H 2 O 2) 3Mg+N 2 =Mg 3 N 2 3)Mg 3 N 2 +8HCl=3MgCl 2 +2NH 4 Cl 4)2MgCl 2 +2Na 2 CO 3 +H 2 O= (MgOH) 2 CO 3 ↓+ CO 2 +4NaCl |
|
1)Al 2 O 3 +2NaOH 2NaAlO2 +H2O 2)NaAlO 2 +NH 4 Cl+H 2 O=NaCl+ Al(OH) 3 ↓+NH 3 3)2NH 3 +H 2 SO 4 =(NH 4) 2 SO 4 4)(NH 4) 2 SO 4 NH 3 +NH 4 HSO 4 |
1)3Cl 2 +6KOH6KCl+KClO 3 +3H 2 O 2)6HCl+KClO 3 =KCl+3Cl 2 +3H 2 O 3)2Fe+3Cl 2 =2FeCl 3 4)2FeCl 3 +Fe3FeCl 2 |
1)3Cu+4HNO 3 =3Cu(NO 3) 2 +2NO 2 +4H 2 O 2)Cu(NO 3) 2 +2NH 3 H 2 O=Cu(OH) 2 + 2NH 4 NO 3 3)Cu(OH) 2 +4NH 3 H 2 O =(OH) 2 + 4H 2 O 4)(OH) 2 +6HCl= CuCl 2 +4NH 4 Cl + 2H 2 O |
|
19 Dokument C 2 Reakcije, potvrđujući odnos razne klase neorganski supstance Date vodene otopine... Napišite jednadžbe za četiri moguće reakcije. Dans supstance: bromovodonična kiselina, ... se taloži tokom reakcije supstancežuta boja gorela na... Zbirni izvještaj predsjednika predmetnih komisija regije Astrakhan o akademskim predmetima državne završne certifikacije za obrazovne programe srednjeg opšteg obrazovanjaIzvještaj4 21,9 40,6 C2 Reakcije, potvrđujući odnos razne klase neorganski supstance 54,1 23,9 9,9 7,7 4,3 C3 Reakcije, potvrđujući odnos organska jedinjenja 56,8 10 ... Kalendarsko-tematsko planiranje nastave u pripremi za Jedinstveni državni ispit iz hemije u školskoj 2013–2014. godini PredmetKalendarsko i tematsko planiranje25) 27.03.2014 Reakcije, potvrđujući odnos razne klase neorganski supstance. Rješenje vježbi C-2...jednostavno supstance. Hemijska svojstva kompleks supstance. Veza razne klase neorganski supstance. Reakcije jonska izmjena... Kalendarsko-tematski plan časova za pripremu za Jedinstveni državni ispit iz hemije za maturante u Barnaulu i na Altajskom teritoriju 2015. godine. Broj lekcijeKalendarsko-tematski plan... (na primjeru spojeva aluminija i cinka). Veza neorganski supstance. Reakcije, potvrđujući odnos razne klase neorganski supstance(37 (C2)). 28. februar 2015... |
Tutor hemije
LEKCIJA 10
10. razred(prva godina studija)
Nastavak. Za početak, vidi br. 22/2005; 1, 2, 3, 5, 6, 8, 9, 11/2006.
Redox reakcije
Plan
1. Oksidacijsko-redukcione reakcije (ORR), stepen oksidacije.
2. Proces oksidacije, najvažniji redukcioni agensi.
3. Proces redukcije, najvažniji oksidanti.
4. Redox dualnost.
5. Glavni tipovi ORR (intermolekularni, intramolekularni, disproporcionalni).
6. ORR vrijednost.
7. Metode sastavljanja ORR jednačina (elektronski i elektronsko-jonski balans).
Sve hemijske reakcije zasnovane na promenama u oksidacionim stanjima uključenih atoma mogu se podeliti u dva tipa: ORR (one koje se javljaju sa promenom oksidacionog stanja) i ne-ORR.
Oksidacijsko stanje– uslovni naboj atoma u molekulu, izračunat na osnovu pretpostavke da u molekulu postoje samo jonske veze.
Pravila za određivanje stepena oksidacije
Oksidacijsko stanje atoma jednostavnih supstanci je nula.
Zbir oksidacijskih stanja atoma u složenoj tvari (u molekulu) jednak je nuli.
Oksidacijsko stanje atoma alkalnih metala je +1.
Oksidacijsko stanje atoma zemnoalkalnih metala je +2.
Oksidacijsko stanje atoma bora i aluminija je +3.
Oksidacijsko stanje atoma vodonika je +1 (u hidridima zemnoalkalnih i zemnoalkalnih metala –1).
Oksidacijsko stanje atoma kisika je –2 (u peroksidima –1).
Bilo koji ORR je skup procesa doniranja i dodavanja elektrona.
Proces odustajanja elektrona naziva se oksidacija. Zovu se čestice (atomi, molekuli ili ioni) koje daju elektrone restauratori. Kao rezultat oksidacije povećava se oksidacijsko stanje redukcionog sredstva. Redukcioni agensi mogu biti čestice u nižim ili srednjim oksidacionim stanjima. Najvažniji redukcioni agensi su: svi metali u obliku jednostavnih supstanci, posebno aktivni; C, CO, NH 3, PH 3, CH 4, SiH 4, H 2 S i sulfidi, vodonik halogenidi i metalni halogenidi, metalni hidridi, metalni nitridi i fosfidi.
Proces dodavanja elektrona naziva se restauracija. Zovu se čestice koje prihvataju elektrone oksidirajuća sredstva. Kao rezultat redukcije, oksidacijsko stanje oksidacijskog sredstva se smanjuje. Oksidirajuća sredstva mogu biti čestice u višim ili srednjim oksidacijskim stanjima. Najvažniji oksidanti: jednostavne nemetalne supstance visoke elektronegativnosti (F 2, Cl 2, O 2), kalijum permanganat, hromati i dihromati, azotna kiselina i nitrati, koncentrovana sumporna kiselina, perhlorna kiselina i perhlorati.
Postoje tri vrste redoks reakcija.
Intermolekularni OVR - oksidacijski agens i redukcijski agens uključeni su u različite tvari, na primjer:

Intramolekularni OVR – oksidaciono sredstvo i redukciono sredstvo su deo jedne supstance.

To mogu biti različiti elementi, na primjer: ili jedan hemijski element

u različitim oksidacijskim stanjima, na primjer: Disproporcionalnost (autooksidacija-samoizlječenje)

– oksidaciono sredstvo i redukciono sredstvo su isti element koji je u srednjem oksidacionom stanju, na primer: OVR imaju veliki značaj

, budući da većina reakcija koje se dešavaju u prirodi pripada ovom tipu (proces fotosinteze, sagorevanje). Osim toga, ORR ljudi aktivno koriste u svojim praktičnim aktivnostima (redukcija metala, sinteza amonijaka):
Za sastavljanje ORR jednadžbi, možete koristiti metodu elektronske ravnoteže (elektronska kola) ili metodu ravnoteže elektronskih jona.

Metoda elektronske ravnoteže:

Metoda ravnoteže elektronsko-jona:
Test na temu “Reakcije oksidacije-redukcije”
1. Kalijum dihromat je tretiran sumpordioksidom u rastvoru sumporne kiseline, a zatim vodenim rastvorom kalijum sulfida. Konačna supstanca X je:
a) kalijum hromat; b) hrom(III) oksid;
2. c) hrom(III) hidroksid; d) hrom(III) sulfid.
Koji produkt reakcije između kalijum permanganata i bromovodonične kiseline može reagirati sa sumporovodikom?
a) brom; b) mangan(II) bromid;
3. Oksidacijom gvožđe(II) jodida sa azotnom kiselinom nastaju jod i dušikov monoksid. Koliki je odnos koeficijenta oksidacionog agensa i koeficijenta redukcionog agensa u jednačini ove reakcije?
a) 4: 1; b) 8: 3; c) 1:1; d) 2:3.
4. Oksidacijsko stanje atoma ugljika u bikarbonatnom ionu je jednako:
a) +2; b) –2; c) +4; d) +5.
5. Kalijum permanganat u neutralnom okruženju se redukuje na:
a) mangan; b) mangan(II) oksid;
c) mangan(IV) oksid; d) kalijum manganat.
6. Zbir koeficijenata u jednadžbi za reakciju mangan dioksida sa koncentriranom hlorovodoničnom kiselinom jednak je:
a) 14; b) 10; c) 6; d) 9.
7. Od navedenih jedinjenja, samo sljedeća pokazuju oksidacijsku sposobnost:
A) sumporna kiselina; b) sumporna kiselina;
c) hidrosulfidna kiselina; d) kalijum sulfat.
8. Od navedenih jedinjenja redoks dualnost pokazuju:
a) vodonik peroksid; b) natrijum peroksid;
c) natrijum sulfit; d) natrijum sulfid.
9. Od sljedećih vrsta reakcija, redoks reakcije su:
a) neutralizacija; b) restauracija;
c) disproporcionalnost; d) razmjena.
10. Oksidacijsko stanje atoma ugljika se numerički ne poklapa s njegovom valencijom u tvari:
a) ugljen-tetrahlorid; b) etan;
c) kalcijum karbid; d) ugljen monoksid.
Ključ za test
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| V | A | A | V | V | G | a, d | a, b, c | b, c | b, c |
Vježbe redoks reakcija
(elektronski i elektronsko-jonski balans)
Zadatak 1. Kreirajte OVR jednačine metodom elektronske ravnoteže, odredite tip OVR.
1. Cink + kalijum dihromat + sumporna kiselina = cink sulfat + hrom(III) sulfat + kalijum sulfat + voda.
Elektronska ravnoteža:

2. Kalijum(II) sulfat + kalijum permanganat + sumporna kiselina = kalaj(IV) sulfat + mangan sulfat + kalijum sulfat + voda.
3. Natrijum jodid + kalijum permanganat + kalijum hidroksid = jod + kalijum manganat + natrijum hidroksid.
4. Sumpor + kalijum hlorat + voda = hlor + kalijum sulfat + sumporna kiselina.
5. Kalijum jodid + kalijum permanganat + sumporna kiselina = mangan(II) sulfat + jod + kalijum sulfat + voda.
6. Gvožđe(II) sulfat + kalijum dihromat + sumporna kiselina = gvožđe(III) sulfat + hrom(III) sulfat + kalijum sulfat + voda.
7. Amonijum nitrat = dušikov oksid (I) + voda.
8. Fosfor + dušična kiselina = fosforna kiselina + dušikov oksid (IV) + voda.
9. Dušična kiselina = dušična kiselina + dušikov oksid (II) + voda.
10. Kalijum hlorat + hlorovodonična kiselina = hlor + kalijum hlorid + voda.
11. Amonijum dihromat = azot + hrom(III) oksid + voda.
12. Kalijum hidroksid + hlor = kalijum hlorid + kalijum hlorat + voda.
13. Sumpor(IV) oksid + brom + voda = sumporna kiselina + bromovodonična kiselina.
14. Sumpor(IV) oksid + vodonik sulfid = sumpor + voda.
15. Natrijum sulfit = natrijum sulfid + natrijum sulfat.
16. Kalijum permanganat + hlorovodonična kiselina = mangan(II) hlorid + hlor + kalijum hlorid + voda.
17. Acetilen + kisik = ugljični dioksid + voda.
18. Kalijum nitrit + kalijum permanganat + sumporna kiselina = kalijum nitrat + mangan(II) sulfat + kalijum sulfat + voda.
19. Silicijum + kalijum hidroksid + voda = kalijev silikat + vodonik.
20. Platina + dušična kiselina + hlorovodonična kiselina = platina(IV) hlorid + dušikov oksid + voda.
21. Arsen sulfid + dušična kiselina = arsenska kiselina + sumpor dioksid + dušikov dioksid + voda.
22. Kalijum permanganat = kalijum manganat + mangan(IV) oksid + kiseonik.
23.
Bakar(I) sulfid + kiseonik + kalcijum karbonat = bakar(II) oksid + kalcijum sulfit +
+ ugljični dioksid.
24.
Gvožđe(II) hlorid + kalijum permanganat + hlorovodonična kiselina = gvožđe(III) hlorid + hlor +
+ mangan(II) hlorid + kalijum hlorid + voda.
25. Gvožđe(II) sulfit + kalijum permanganat + sumporna kiselina = gvožđe(III) sulfat + mangan(II) sulfat + kalijum sulfat + voda.
Odgovori na vježbe u zadatku 1


Prilikom primjene metode polureakcije (elektron-ionska ravnoteža) treba imati na umu da se u vodenim otopinama vezanje viška kisika i dodavanje kisika redukcijskim agensom odvija različito u kiselim, neutralnim i alkalnim sredinama. U kiselim otopinama, višak kisika je vezan protonima kako bi formirao molekule vode, a u neutralnim i alkalnim otopinama molekulima vode da bi formirao hidroksidne ione. Dodavanje kisika redukcijskim sredstvom vrši se u kiselim i neutralnim sredinama zbog molekula vode sa stvaranjem vodikovih iona, au alkalnoj sredini - zbog hidroksidnih iona sa stvaranjem molekula vode.
Neutralno okruženje:
oksidant + H 2 O = ... + OH – ,
redukciono sredstvo + OH – = ... + H 2 O.
kiselo okruženje:
oksidant + H + = ... + H 2 O,
redukciono sredstvo + H 2 O = ... + H + .
Zadatak 2. Koristeći metodu ravnoteže elektron-iona, sastavite jednadžbe za redoks reakcije koje se dešavaju u određenom okruženju.
1. Natrijum sulfit + kalijum permanganat + voda = .......................
2. Gvožđe(II) hidroksid + kiseonik + voda = ...................................
3. Natrijum bromid + kalijum permanganat + voda = ..........................
4. Vodonik sulfid + brom + voda = sumporna kiselina + ....................
5. Srebro(I) nitrat + fosfin + voda = srebro + fosforna kiselina + ...................................
U ALKALNOM OKRUŽENJU
1. Natrijum sulfit + kalijum permanganat + kalijum hidroksid = .......................
2. Kalijum bromid + hlor + kalijum hidroksid = kalijum bromat + ....................
3. Mangan(II) sulfat + kalijum hlorat + kalijum hidroksid = kalijum manganat + ...................... .
4. Hrom(III) hlorid + brom + kalijum hidroksid = kalijum hromat + ....................
5. Mangan(IV) oksid + kalijum hlorat + kalijum hidroksid = kalijum manganat + ...................... .
U kiseloj sredini
1. Natrijum sulfit + kalijum permanganat + sumporna kiselina = .......................
2. Kalijum nitrit + kalijum jodid + sumporna kiselina = azot oksid (II) + ......................
3. Kalijum permanganat + dušikov oksid (II) + sumporna kiselina = dušikov oksid (IV) + ...................... .
4. Kalijum jodid + kalijum bromat + hlorovodonična kiselina = .......................
5. Mangan(II) nitrat + olovo(IV) oksid + azotna kiselina = manganova kiselina +
+ ...................... .
Odgovori na vježbe u zadatku 2
N E U T R A L OKRUŽENJE

Zadatak 3. Koristeći metodu ravnoteže elektron-jona, sastavite ORR jednačine.
1. Mangan(II) hidroksid + hlor + kalijum hidroksid = mangan(IV) oksid + ...................... .
Elektronsko-jonski balans:

2. Mangan(IV) oksid + kiseonik + kalijum hidroksid = kalijum manganat + ...................
3. Gvožđe(II) sulfat + brom + sumporna kiselina = .......................
4. Kalijum jodid + gvožđe(III) sulfat = ....................... .
5. Vodonik bromid + kalijum permanganat = ..................................
6. Hlorovodonik + hrom(VI) oksid = hrom(III) hlorid + ........................
7. Amonijak + brom = ......................
8. Bakar(I) oksid + azotna kiselina = azot oksid(II) + .......................
9. Kalijum sulfid + kalijum manganat + voda = sumpor + .......................
10. Dušikov oksid (IV) + kalijum permanganat + voda = .......................
11. Kalijum jodid + kalijum dihromat + sumporna kiselina = ..................................
12. Olovo(II) sulfid + vodikov peroksid = ..............................
13. Hlorovodonična kiselina + vodikov peroksid = hlorovodonična kiselina + ....................
14. Kalijum jodid + vodikov peroksid = ...................................
15. Kalijum permanganat + vodonik peroksid = mangan(IV) oksid + ...................................
16. Kalijum jodid + kalijum nitrit + octena kiselina = azot oksid (II) + ................................... .
17. Kalijum permanganat + kalijev nitrit + sumporna kiselina = ..................................
18. Sumporna kiselina + hlor + voda = sumporna kiselina + .......................
19. Sumporna kiselina + sumporovodik = sumpor + ...................................
Predloženo je 2012 nova forma zadaci C2 - u obliku teksta koji opisuje redoslijed eksperimentalnih radnji koje je potrebno pretvoriti u jednadžbe reakcija.
Teškoća ovakvog zadatka je u tome što školarci veoma slabo razumiju eksperimentalnu, nepapirnu hemiju, i ne razumiju uvijek korištene termine i procese koji se odvijaju. Pokušajmo to shvatiti.
Vrlo često, koncepte koji se hemičaru čine potpuno jasnim aplikanti percipiraju pogrešno, ne onako kako se očekivalo. Rječnik daje primjere nesporazuma.
Rječnik nejasnih pojmova.
- Hitch- ovo je jednostavno određeni dio tvari određene mase (izmjeren je na vagi). Nema veze sa nadstrešnicom nad tremom.
- Zapalite- zagrijte supstancu na visoku temperaturu i zagrijavajte dok ne završi hemijske reakcije. Ovo nije "miješanje s kalijem" ili "pirsing noktom".
- “Raznijeli su mješavinu plinova”- to znači da su supstance reagirale eksplozivno. Obično se za to koristi električna iskra. Tikvica ili posuda u ovom slučaju nemoj eksplodirati!
- Filter- odvojiti talog od rastvora.
- Filter— propuštati rastvor kroz filter da se odvoji talog.
- Filtrirati- ovo je filtrirano rješenje.
- Otapanje supstance je prelazak supstance u rastvor. Može se dogoditi bez kemijskih reakcija (na primjer, kada se natrijum hlorid NaCl otopi u vodi, dobije se otopina natrijum hlorida NaCl, a ne odvojeno lužina i kiselina), ili tokom procesa rastvaranja tvar reagira s vodom i formira otopinu druge supstance (kada se rastvori barijum oksid, može nastati rastvor barijum hidroksida). Supstance se mogu rastvoriti ne samo u vodi, već iu kiselinama, alkalijama itd.
- Isparavanje je uklanjanje vode i isparljivih tvari iz otopine bez raspadanja čvrstih tvari sadržanih u otopini.
- Isparavanje- Ovo je jednostavno smanjenje mase vode u rastvoru ključanjem.
- Fuzija- ovo je zajedničko zagrijavanje dvije ili više čvrstih tvari do temperature na kojoj se počinju topiti i međusobno djelovati. Nema ništa zajedničko sa riječnom plovidbom.
- Sediment i ostatak.
Ovi pojmovi se vrlo često brkaju. Iako su to potpuno različiti koncepti.
“Reakcija se nastavlja oslobađanjem precipitata”- to znači da je jedna od supstanci dobijenih u reakciji slabo rastvorljiva. Takve tvari padaju na dno reakcione posude (epruvete ili tikvice).
"ostatak" je supstanca koja lijevo, nije bio u potpunosti konzumiran ili uopće nije reagirao. Na primjer, ako je mješavina nekoliko metala tretirana kiselinom, a jedan od metala nije reagirao, može se nazvati ostatak. - Saturated otopina je otopina u kojoj je, pri datoj temperaturi, koncentracija tvari najveća moguća i više se ne otapa.
Nezasićene otopina je otopina u kojoj koncentracija tvari nije maksimalna moguća u takvoj otopini možete dodatno otopiti još neku količinu te tvari dok se ne zasiti.
Razrijeđen I "veoma" razblažen rješenje je vrlo uslovan koncept, više kvalitativni nego kvantitativan. Pretpostavlja se da je koncentracija supstance niska.
Za kiseline i alkalije se također koristi izraz "koncentrisano" rješenje. Ovo je takođe uslovna karakteristika. Na primjer, koncentrirana hlorovodonična kiselina je samo oko 40% koncentrirana. Koncentrovana sumporna kiselina je bezvodna, 100% kiselina.
Da biste riješili takve probleme, morate jasno poznavati svojstva većine metala, nemetala i njihovih spojeva: oksida, hidroksida, soli. Potrebno je ponoviti svojstva dušične i sumporne kiseline, kalijum permanganata i dikromata, redoks svojstva raznih jedinjenja, elektrolizu rastvora i talina raznih supstanci, reakcije raspadanja jedinjenja različitih klasa, amfoternost, hidrolizu soli i drugih jedinjenja, međusobna hidroliza dvije soli.
Osim toga, potrebno je imati predstavu o boji i stanju agregacije većine supstanci koje se proučavaju - metala, nemetala, oksida, soli.
Zato ovu vrstu zadatka analiziramo na samom kraju studija opšte i neorganske hemije.
Pogledajmo nekoliko primjera takvih zadataka.
Primjer 1: Produkt reakcije litijuma sa dušikom tretiran je vodom. Nastali plin je propuštan kroz otopinu sumporne kiseline sve dok se hemijske reakcije nisu zaustavile. Dobiveni rastvor je tretiran barijum hloridom. Rastvor je filtriran, a filtrat je pomešan sa rastvorom natrijum nitrita i zagrejan.
Rješenje:
- Litijum reaguje sa azotom na sobnoj temperaturi da formira čvrsti litijum nitrid:
6Li + N 2 = 2Li 3 N - Kada nitridi reaguju sa vodom, nastaje amonijak:
Li 3 N + 3H 2 O = 3LiOH + NH 3 - Amonijak reaguje sa kiselinama, formirajući medijum i kisele soli. Riječi u tekstu “prije prestanka hemijskih reakcija” to znače srednje soli, jer će početno nastala kisela sol dalje komunicirati s amonijakom i, kao rezultat, amonijev sulfat će biti u otopini:
2NH 3 + H 2 SO 4 = (NH 4) 2 SO 4 - Reakcija razmjene između amonijum sulfata i barij klorida događa se stvaranjem taloga barijum sulfata:
(NH 4) 2 SO 4 + BaCl 2 = BaSO 4 + 2NH 4 Cl - Nakon uklanjanja taloga, filtrat sadrži amonijum hlorid, koji reaguje sa rastvorom natrijum nitrita da bi se oslobodio azot, a ova reakcija se dešava već na 85 stepeni:
Primjer 2:Izvagano aluminij je otopljen u razrijeđenoj dušičnoj kiselini i oslobođena je plinovita jednostavna tvar. U nastalu otopinu dodavan je natrijum karbonat sve dok se potpuno ne zaustavi oslobađanje plina. Odustao talog je filtriran I kalcinirano, filtrat ispario, rezultirajuća čvrsta supstanca ostalo je istopljeno sa amonijum hloridom. Otpušteni plin je pomiješan s amonijakom i dobivena smjesa je zagrijana.
Rješenje:
- Aluminij se oksidira dušičnom kiselinom, stvarajući aluminij nitrat. Ali proizvod redukcije dušika može biti različit, ovisno o koncentraciji kiseline. Ali moramo zapamtiti da kada dušična kiselina reagira s metalima ne oslobađa se vodonik! Dakle, samo dušik može biti jednostavna supstanca:
10Al + 36HNO 3 = 10Al(NO 3) 3 + 3N 2 + 18H 2 O - Natrijum nitrat ostaje u rastvoru. Kada se spoji s amonijevim solima, dolazi do oksidacijsko-redukcione reakcije i oslobađa se dušikov oksid (I) (isti proces se događa kada se kalcinira amonijum nitrat):
NaNO 3 + NH 4 Cl = N 2 O + 2H 2 O + NaCl - Dušikov oksid (I) je aktivno oksidaciono sredstvo koje reaguje sa redukcijskim agensima i stvara dušik:
3N 2 O + 2NH 3 = 4N 2 + 3H 2 O
Primjer 3: Aluminijum oksid je fuzionisan sa natrijum karbonatom, a nastala čvrsta supstanca je otopljena u vodi. Sumpor dioksid je propuštan kroz nastalu otopinu sve dok reakcija nije potpuno prestala. Nastali precipitat se odfiltrira, a u filtriranu otopinu doda se bromna voda. Dobiveni rastvor je neutralizovan natrijum hidroksidom.
Rješenje:
- Aluminij oksid je amfoterni oksid kada se stapa sa alkalijama ili karbonatima alkalnih metala, stvara aluminate:
Al 2 O 3 + Na 2 CO 3 = 2NaAlO 2 + CO 2 - Natrijum aluminat, kada se rastvori u vodi, formira hidrokso kompleks:
NaAlO 2 + 2H 2 O = Na - Otopine hidrokso kompleksa reagiraju s kiselinama i kiselim oksidima u otopini, stvarajući soli. Međutim, aluminijum sulfit ne postoji u vodenom rastvoru, tako da će se aluminijum hidroksid taložiti. Imajte na umu da će reakcija proizvesti kiselu sol - kalijev hidrosulfit:
Na + SO 2 = NaHSO 3 + Al(OH) 3 - Kalijum hidrosulfit je redukcioni agens i oksidira se bromnom vodom u hidrogen sulfat:
NaHSO 3 + Br 2 + H 2 O = NaHSO 4 + 2HBr - Dobivena otopina sadrži kalijum hidrogen sulfat i bromovodičnu kiselinu. Prilikom dodavanja lužine, morate uzeti u obzir interakciju obje tvari s njom:
NaHSO 4 + NaOH = Na 2 SO 4 + H 2 O
HBr + NaOH = NaBr + H 2 O
Primjer 4: Cink sulfid je tretiran rastvorom hlorovodonične kiseline, nastali gas je propušten kroz višak rastvora natrijum hidroksida, zatim je dodat rastvor gvožđe (II) hlorida. Nastali talog je ispaljen. Nastali plin je pomiješan s kisikom i prešao preko katalizatora.
Rješenje:
- Cink sulfid reaguje sa hlorovodoničnom kiselinom, oslobađajući gas - sumporovodik:
ZnS + HCl = ZnCl 2 + H 2 S - Vodonik sulfid - u vodenom rastvoru reaguje sa alkalijama, formirajući kisele i srednje soli. Budući da zadatak govori o višku natrijevog hidroksida, nastaje prosječna sol - natrijev sulfid:
H 2 S + NaOH = Na 2 S + H 2 O - Natrijum sulfid reaguje sa željeznim hloridom i formira talog željeznog (II) sulfida:
Na 2 S + FeCl 2 = FeS + NaCl - Pečenje je interakcija čvrstih materija sa kiseonikom tokom visoka temperatura. Kada se sulfidi prže, oslobađa se sumpor dioksid i stvara se željezov (III) oksid:
FeS + O 2 = Fe 2 O 3 + SO 2 - Sumpor dioksid reagira s kisikom u prisustvu katalizatora, stvarajući sumporni anhidrid:
SO 2 + O 2 = SO 3
Primjer 5: Silicijum oksid je kalciniran sa velikim viškom magnezijuma. Dobivena mješavina tvari tretirana je vodom. Ovo je oslobodilo gas koji je spaljen u kiseoniku. Čvrsti produkt sagorevanja otopljen je u koncentrovanom rastvoru cezijum hidroksida. U nastalu otopinu dodana je hlorovodonična kiselina.
Rješenje:
- Kada se magnezijum redukuje silicijum oksid, nastaje silicijum koji reaguje sa viškom magnezijuma. Ovo proizvodi magnezijum silicid:
SiO 2 + Mg = MgO + Si
Si + Mg = Mg 2 SiSa velikim viškom magnezijuma, ukupna jednačina reakcije može se napisati:
SiO 2 + Mg = MgO + Mg 2 Si - Kada se dobijena smeša rastvori u vodi, magnezijum silicid se otapa, nastaju magnezijum hidroksid i silan (magnezijum oksid reaguje sa vodom samo kada prokuva):
Mg 2 Si + H 2 O = Mg(OH) 2 + SiH 4 - Kada silan gori, formira silicijum oksid:
SiH 4 + O 2 = SiO 2 + H 2 O - Silicijum oksid je kiseli oksid, on reaguje sa alkalijama i formira silikate:
SiO 2 + CsOH = Cs 2 SiO 3 + H 2 O - Kada su rastvori silikata izloženi kiselinama jačim od silicijumske kiseline, oslobađa se u obliku taloga:
Cs 2 SiO 3 + HCl = CsCl + H 2 SiO 3
Zadaci za samostalan rad.
- Bakar nitrat je kalciniran, a nastali čvrsti talog je otopljen u sumpornoj kiselini. Vodonik sulfid je propušten kroz rastvor, nastali crni talog je ispaljen, a čvrsti ostatak je otopljen zagrevanjem u koncentrovanoj azotnoj kiselini.
- Kalcij fosfat je fuzioniran s ugljenom i pijeskom, zatim je nastala jednostavna tvar spaljena u višku kisika, produkt sagorijevanja otopljen je u višku kaustične sode. U nastalu otopinu dodana je otopina barij hlorida. Nastali talog je tretiran sa viškom fosforne kiseline.
- Bakar je otopljen u koncentrovanoj azotnoj kiselini, nastali gas je pomešan sa kiseonikom i otopljen u vodi. Cink oksid je otopljen u nastaloj otopini, a zatim je u otopinu dodan veliki višak otopine natrijum hidroksida.
- Suvi natrijum hlorid je tretiran koncentrovanom sumpornom kiselinom na niskoj temperaturi, a nastali gas je propušten u rastvor barijum hidroksida. Dobijenoj otopini dodana je otopina kalijum sulfata. Nastali sediment je stopljen sa ugljem. Dobivena supstanca je tretirana hlorovodoničnom kiselinom.
- Uzorak aluminijum sulfida tretiran je hlorovodoničnom kiselinom. Istovremeno se oslobađa plin i stvara se bezbojni rastvor. Dobijenoj otopini dodana je otopina amonijaka, a plin je propušten kroz otopinu olovnog nitrata. Nastali talog je tretiran rastvorom vodikovog peroksida.
- Aluminijski prah je pomiješan sa sumpornim prahom, smjesa je zagrijana, nastala supstanca je tretirana vodom, oslobođen je plin i formiran je talog kojem je dodan višak otopine kalijevog hidroksida dok se potpuno ne otopi. Ovaj rastvor je uparen i kalcinisan. Dobijenoj krutini je dodan višak otopine hlorovodonične kiseline.
- Rastvor kalijum jodida tretiran je rastvorom hlora. Nastali talog je tretiran rastvorom natrijum sulfita. Dobijenom rastvoru prvo je dodat rastvor barijum hlorida, a nakon odvajanja taloga dodat je rastvor srebrnog nitrata.
- Sivo-zeleni prah hrom (III) oksida fuzionisan je sa viškom lužine, nastala supstanca je otopljena u vodi, što je rezultiralo tamnozelenom otopinom. U nastalu alkalnu otopinu dodan je vodikov peroksid. Rezultat je žuta otopina koja, kada se doda sumporna kiselina, postaje narandžasta. Kada se sumporovodik propušta kroz nastalu zakiseljenu narandžastu otopinu, ona postaje mutna i ponovo postaje zelena.
- (MIOO 2011, rad na obuci) Aluminijum je otopljen u koncentrovanom rastvoru kalijum hidroksida. Ugljični dioksid je propuštan kroz nastalu otopinu do prestanka taloženja. Precipitat je filtriran i kalciniran. Dobiveni čvrsti ostatak je fuzionisan sa natrijum karbonatom.
- (MIOO 2011, rad na obuci) Silicijum je otopljen u koncentrovanom rastvoru kalijum hidroksida. U nastalu otopinu dodan je višak hlorovodonične kiseline. Zamućeni rastvor je zagrejan. Nastali precipitat je filtriran i kalciniran sa kalcijum karbonatom. Napišite jednadžbe za opisane reakcije.
formiranje vode. Otopina dobivena nakon prolaska plinova kroz vodu imala je kiselu reakciju. Kada je ovaj rastvor tretiran srebrovim nitratom, formirano je 14,35 g bijelog taloga. Odrediti kvantitativni i kvalitativni sastav početne mješavine plinova. Rješenje.
Plin koji sagorijeva u vodu je vodonik; Reagovati na sunčeva svetlost sa eksplozijom vodonika sa kiseonikom, vodonika sa hlorom. Očigledno je da je u mešavini sa vodonikom bilo hlora, jer rezultirajući HC1 je visoko rastvorljiv u vodi i daje bijeli talog sa AgN03.
Dakle, smjesa se sastoji od plinova H2 i C1:
1 mol 1 mol
HC1 + AgN03 -» AgCl 4- HN03.
x mol 14,35
Pri tretiranju 1 mola HC1 nastaje 1 mol AgCl, a pri tretiranju x mol 14,35 g ili 0,1 mol. Mr(AgCl) = 108 + 2 4- 35,5 = 143,5, M(AgCl) = 143,5 g/mol,
v= - = = 0,1 mol,
x = 0,1 mol HC1 se nalazio u rastvoru. 1 mol 1 mol 2 mol H2 4- C12 2HC1 x mol y mol 0,1 mol
x = y = 0,05 mol (1,12 l) vodonika i hlora su reagovali da nastane 0,1 mol
NS1. Smjesa je sadržavala 1,12 litara hlora i 1,12 litara vodonika + 1,12 litara (višak) = 2,24 litara.
Primjer 6. U laboratoriji postoji mješavina natrijum hlorida i natrijum jodida. 104,25 g ove smjese je rastvoreno u vodi i višak hlora je propušten kroz nastali rastvor, zatim je rastvor uparen do suva i ostatak je kalcinisan do konstantne težine na 300 °C.
Ispostavilo se da je masa suhe tvari 58,5 g Odredite sastav početne smjese u postocima.
Mr(NaCl) = 23 + 35,5 = 58,5, M(NaCl) = 58,5 g/mol, Mr(Nal) = 127 + 23 = 150 M(Nal) = 150 g/mol.
U početnoj smeši: masa NaCl - x g, masa Nal - (104,25 - x) g.
Kada se natrijum hlorid i jodid propuste kroz rastvor, njime se istiskuje jod. Kada je suhi ostatak propušten, jod je ispario. Dakle, samo NaCl može biti suha tvar.
U dobivenoj tvari: masa početnog NaCl x g, masa rezultirajućeg (58,5-x):
2 150 g 2 58,5 g
2NaI + C12 -> 2NaCl + 12
(104,25 - x) g (58,5 - x) g
2.150 (58.5 - x) = 2.58.5 (104.25-x)
x = - = 29,25 (g),
one. NaCl u smeši je bio 29,25 g, a Nal - 104,25 - 29,25 = 75 (g).
Nađimo sastav smjese (u procentima):
w(Nal) = 100% = 71,9%,
©(NaCl) = 100% - 71,9% = 28,1%.
Primer 7: 68,3 g mešavine nitrata, jodida i kalijum hlorida rastvoreno je u vodi i tretirano sa hlornom vodom. Kao rezultat, oslobođeno je 25,4 g joda (čija je rastvorljivost u vodi zanemarena). Isti rastvor je tretiran srebrnim nitratom. Palo je 75,7 g sedimenta. Odredite sastav početne smjese.
Klor ne reaguje sa kalijum nitratom i kalijum hloridom:
2KI + C12 -» 2KS1 + 12,
2 mol - 332 g 1 mol - 254 g
Mg(K1) = 127 + 39 - 166,
x = = 33,2 g (KI je bio u smeši).
v(KI) - - = = 0,2 mol.
1 mol 1 mol
KI + AgN03 = Agl + KN03.
0,2 mol x mol
x = = 0,2 mol.
Mr(Agl) = 108 + 127 = 235,
m(Agl) = Mv = 235 0,2 = 47 (r),
tada će biti AgCl
75,7 g - 47 g = 28,7 g.
74,5 g 143,5 g
KCl + AgN03 = AgCl + KN03
X = 1 L_ = 14,9 (KCl).
Dakle, smjesa je sadržavala: 68,3 - 33,2 - 14,9 = 20,2 g KN03.
Primer 8. Za neutralizaciju 34,5 g oleuma utroši se 74,5 ml 40% rastvora kalijum hidroksida. Koliko mola sumpor-oksida (VI) ima po 1 molu sumporne kiseline?
100% sumporna kiselina otapa sumpor oksid (VI) u bilo kojoj proporciji. Sastav izražen formulom H2S04*xS03 naziva se oleum. Izračunajmo koliko je kalijevog hidroksida potrebno za neutralizaciju H2S04:
1 mol 2 mol
H2S04 + 2KON -> K2S04 + 2N20 xl mol y mol
y - 2*x1 mol KOH ide na neutralizaciju S03 u oleumu. Izračunajmo koliko je KOH potrebno za neutralizaciju 1 mola S03:
1 mol 2 mol
S03 4- 2KOH -> K2SO4 + H20 x2 mol z mol
z - 2 x2 mol KOH ide na neutralizaciju SOg u oleumu. Za neutralizaciju oleuma koristi se 74,5 ml 40% rastvora KOH, tj. 42 g ili 0,75 mol KOH.
Dakle, 2 xl + 2x 2 = 0,75,
98 xl + 80 x2 = 34,5 g,
xl = 0,25 mol H2S04,
x2 = 0,125 mol S03.
Primjer 9 Postoji mješavina kalcijum karbonata, cink sulfida i natrijum hlorida. Ako se 40 g ove mješavine izloži višku hlorovodonične kiseline, oslobodiće se 6,72 litara gasova koji će u interakciji sa viškom sumpor-oksida (IV) osloboditi 9,6 g sedimenta. Odredite sastav smjese.
Kada je smjesa bila izložena višku hlorovodonične kiseline, mogli su se osloboditi ugljični monoksid (IV) i vodonik sulfid. Samo sumporovodik reaguje sa sumporovim (IV) oksidom, pa se njegov volumen može izračunati iz količine oslobođenog taloga:
CaC03 + 2HC1 -> CaC12 + H20 + C02t(l)
100 g - 1 mol 22,4 l - 1 mol
ZnS + 2HC1 -> ZnCl2 + H2St (2)
97 g - 1 mol 22,4 l - 1 mol
44,8 l - 2 mol 3 mol
2H2S + S02 -» 3S + 2H20 (3)
xl l 9,6 g (0,3 mol)
xl = 4,48 l (0,2 mol) H2S; iz jednačina (2 - 3) jasno je da je ZnS bio 0,2 mol (19,4 g):
2H2S + S02 -> 3S + 2H20.
Očigledno je da je ugljični monoksid (IV) u smjesi bio:
6,72 l - 4,48 l = 2,24 l (C02).